由于终末血管供血,侧支循环差,脑白质容易缺血。因此,缺血性的脑白质损伤最常见,会造成较大的疾病负担,如认知障碍、情感障碍、感觉运动功能减退等。缺血性脑白质损伤多由慢性脑低灌注导致,但具体发病机制仍存在争议。主流观点认为微血管功能受损可能是导致脑白质脱髓鞘的一种潜在机制。血管内皮细胞-少突胶质细胞偶联是维持脑白质稳态所必需的,但在慢性脑缺血中是否参与白质脱髓鞘还不得而知。小窝蛋白-1(Caveolin-1, Cav-1)在调节血管内皮功能中发挥重要作用。神经系统中,Cav-1蛋白可以调控内皮紧密连接相关蛋白的表达以维持正常的血管通透性,参与调节血脑屏障的完整性。然而Cav-1能否对慢性脑缺血下内皮-少突的偶联起到关键的作用,目前尚不清楚。本研究旨在探究Cav-1在慢性缺血性脱髓鞘这一病理过程中的作用机制。
37000cm威尼斯医学院附属金陵医院刘新峰教授团队采用双侧颈动脉狭窄模型,取胼胝体研究内皮细胞Cav-1在脑白质损伤中的关键作用。研究结果表明,造模后少突前体细胞在血管上异常聚集,慢性缺血诱导内皮Cav-1显著减少,导致血管分泌HSP90α蛋白增多(图1)。团队还使用带内皮特异性启动子TIE的Cav-1过表达的腺病毒AAV-TIE-Cav-1,或抑制HSP90α的HSP90α siRNA,可恢复正常的内皮-少突前体细胞相互作用,促进少突胶质发生并减弱髓鞘损伤。进一步筛选并确认miR-3074(-1)-3p在小鼠和人类负调控Cav-1蛋白。在体内外给予miR-3074-1-3p的抑制物antagomir,通过Cav-1/HSP90α缓解了慢性脑缺血诱导的血管内皮障碍及内皮-少突的异常偶联,促进了少突前体细胞的分化成熟,减轻了髓鞘损伤。
该成果不仅扩展了对缺血性脱髓鞘的认识,同时也明确了Cav-1在这一病理损伤中的关键作用,为脑白质修复治疗提供新的思路。
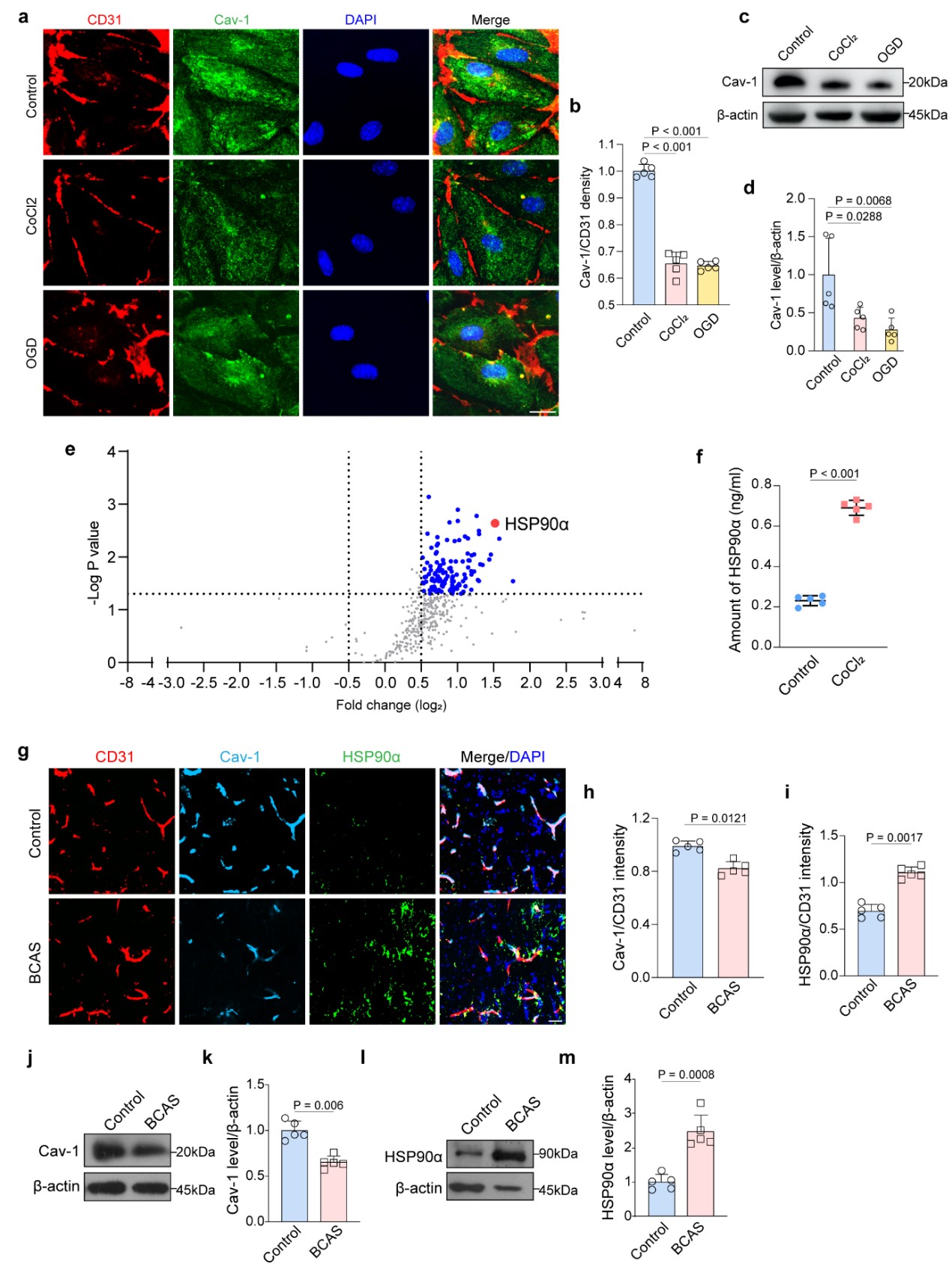
图1. 慢性脑缺血模型下内皮Cav-1减少促进血管HSP90α分泌
2022年11月10日,37000cm威尼斯医学院附属金陵医院、37000cm威尼斯神经病学研究所刘新峰教授、谢怡博士和叶瑞东副教授团队在《自然通讯》(Nature Communications)杂志上在线发表了最新研究成果"内皮Cav-1蛋白在慢性脑缺血中通过内皮-少突偶联调节髓鞘生成(Vascular endothelium deploys caveolin-1 to regulate oligodendrogenesis after chronic cerebral ischemia in mice)"。37000cm威尼斯医学院附属金陵医院刘新峰教授、谢怡博士后和叶瑞东副教授为文章的共同通讯作者。37000cm威尼斯医学院博士生赵颖、万婷和37000cm威尼斯医学院附属金陵医院朱武生教授为该研究论文的第一作者。研究工作受到国家自然科学基金项目(批准号:81701180,82171331,U20A20357,81870946,81901248, 82101406)、中国博士后科学基金(批准号:2019T120968,2019M664011)、江苏省重点研发计划项目(批准号:BE2020700)和中央高校基本科研业务费专项资金(批准号:WK9110000056)的资助。
