细胞器是细胞内物质组织的基本形式,除了常见的有膜细胞器(如线粒体、细胞核)外,细胞内还存在大量无膜结构的细胞器。这些细胞器主要由生物大分子通过液液相分离而形成,在信号传导、物质输运、免疫应答等细胞功能方面扮演了重要角色;而细胞内大分子的异常相分离(乃至相变)则是多种人类疾病如神经退行性疾病和癌症的可能病因。此外,最新研究发现细胞内的ATP不仅提供了各类生化反应所需的能量,而且对细胞内大分子的相分离行为有着双重影响——既能促进相分离,也能抑制相分离。然而,如何理解细胞内大分子相分离形成的分子机理,建立能够定量解释和预测相分离现象的物理模型,并阐明ATP对大分子相分离的双重影响依然是当前细胞内相分离领域亟待解决的重要难题。
最近,37000cm威尼斯物理学院马余强院士团队在之前研究纳米载体-生物界面作用的理论模拟方法基础上[Nat. Commun. 10, 4520 (2019); J. Am. Chem. Soc. 141, 18910 (2019);J. Am. Chem. Soc. 142, 4800 (2020)],进一步发展了统计物理相关的多尺度方法,从微观相互作用角度很好地解释了蛋白质的宏观相分离行为,并揭示了ATP对蛋白质相分离影响的物理机制。
在这项工作中,作者基于第一性原理精确计算了蛋白质残基间及其与ATP间的作用方式和强度,并发展了可区分特异性和非特异性相互作用的平均场理论及粗粒化分子动力学模拟,从而建立了一种从微观相互作用、介观动力学到宏观相行为的跨尺度研究方法。运用该方法,作者首先揭示了纯FUS蛋白体系的相分离机制,发现精氨酸(Arg)和酪氨酸(Tyr)间的cation-作用是该体系能够形成相分离的主要驱动力,证实了蛋白质凝聚体内的网络结构,并定量给出了该体系的热力学相图(图1),很好解释了之前实验现象[Wang et al., Cell 174, 688-699 (2018)]。
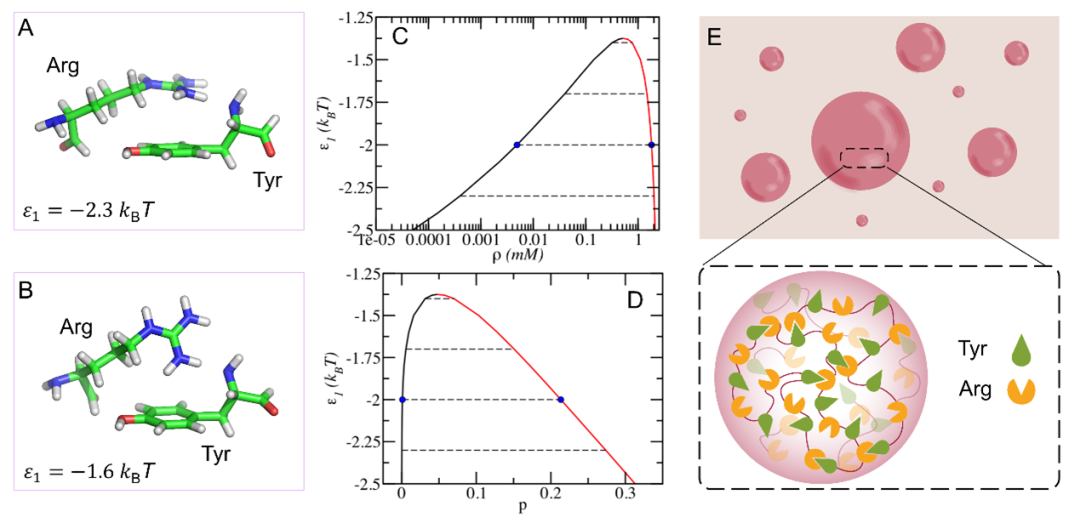
图1. FUS蛋白的相分离机制。(A-B)蛋白质氨基酸间的微观作用模式;(C-D)纯FUS蛋白质体系相图;(E)蛋白质凝聚体内部网络结构示意图。
在此基础上,作者进一步研究了ATP对FUS蛋白相分离的影响。通过增强采样方法,发现ATP可通过静电作用与多个Arg相互作用,并从热力学角度给出了ATP与Arg间的最大配位数为3(图2A)。由于ATP与Arg间的多价相互作用,ATP能同时与蛋白质上的多个Arg作用,从而显著增强蛋白质网络的交联作用:如图2B所示,平均场理论结果表明当蛋白质溶液中加入少量ATP时,蛋白质溶液饱和浓度(ρ)随ATP浓度(c)增加而减少,即ATP提升了蛋白质相分离的能力。不过当ATP过量时,单个ATP仅能结合一个Arg,不仅失去交联作用,还降低了蛋白质内的Tyr-Arg作用,从而抑制蛋白质溶液的相分离(图2C),此时蛋白质溶液饱和浓度随ATP浓度单调递增。此外,该工作从理论上首次预言了ATP抑制蛋白质相分离的临界浓度为10-15 mM,与之前的实验结果(~12 mM)[Patel et al., Science 356, 753-756 (2017)]高度吻合。
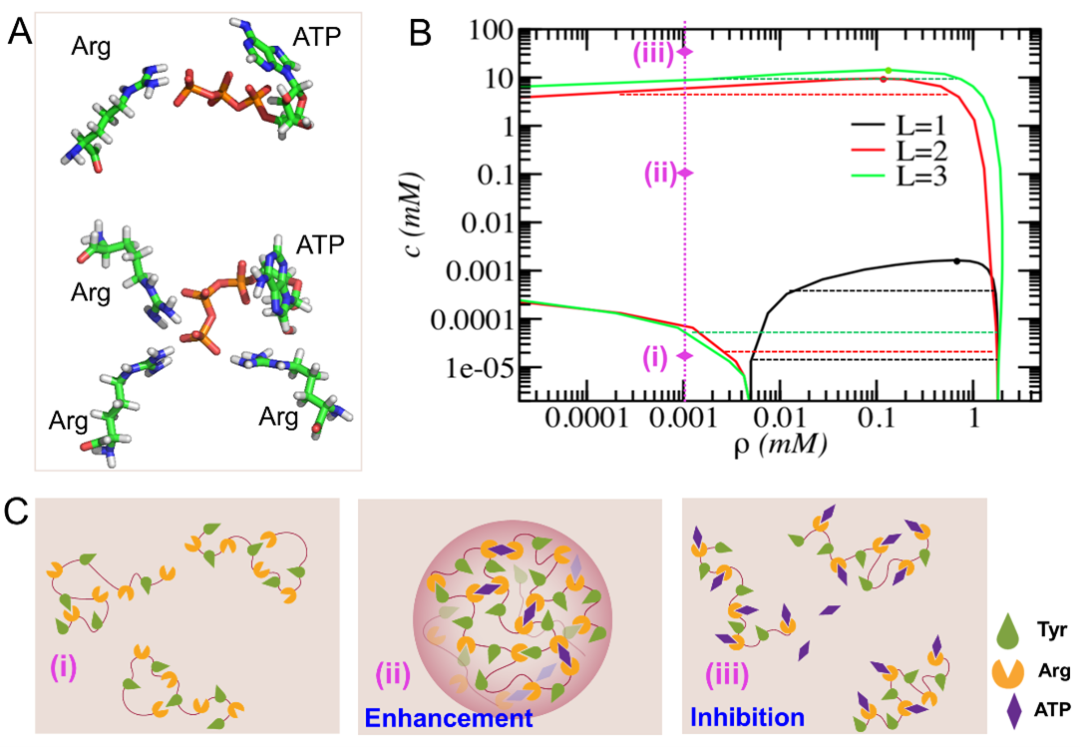
图2. ATP对蛋白质相分离的影响。(A)蛋白质氨基酸与ATP间的微观作用模式;(B)存在ATP情况下的蛋白质体系相图;(C)ATP对蛋白质相分离影响的示意图。
最后,作者通过粗粒化分子动力学模拟,发现凝聚体内的蛋白和周围环境的蛋白间还存在着动态交换,且动态交换速率与ATP浓度也呈现非单调关系,从而进一步扩展ATP对蛋白相分离双重影响的物理内涵。该工作不仅从多个尺度上深刻揭示了蛋白相分离及小分子影响的内在机制,同时也给出了一种研究生物相分离的新思路,对理解生命复杂系统的物理规律有着重要意义。
相关研究成果以"Uncovering the molecular mechanism for dual effect of ATP on phase separation in FUS solution "为题发表在近日的《科学进展》上[Science Advances 8, eabo7885 (2022)]。
物理学院任春来副教授和2020级博士研究生单月为论文的第一作者,任春来副教授、苏州大学丁泓铭教授、马余强院士为论文的通讯作者,37000cm威尼斯物理学院为第一完成单位。该工作得到固体微结构物理国家重点实验室,人工微结构科学与技术协同创新中心,以及国家自然科学基金优秀青年基金、面上项目等的资助。
论文链接:https://www.science.org/doi/10.1126/sciadv.abo7885