流行病学研究表明,雾霾中的PM2.5、PM1以及香烟烟雾颗粒等可吸入细颗粒物(FPM)的长期暴露与肺癌的发生密切相关,FPM浓度每升高10 μg/m3,肺癌发生的可能性就增加8%。尽管随着一系列环境治理举措的不断开展,近几年来国内空气质量得到明显改善,FPM平均暴露浓度从前几年的近百降低到30 μg/m3,但还是远高于WHO公布的安全范围(10 μg/m3)。由此可见,可吸入细颗粒物的潜在生物危害将在一段时间内持续存在。
目前,关于FPM致癌的研究主要集中在颗粒物诱发基因突变等方面。但是,从肿瘤细胞出现,到其发展成为肿瘤组织是较为复杂和长期的过程。对于大多数早期出现的肿瘤细胞,机体可以借助自身免疫防御能力,如杀伤性T细胞(CTLs)等,将其及时清除掉,避免癌症的发生。FPM如何协助肿瘤细胞逃避免疫监视和防御,最终形成肿瘤组织,是阐明环境污染颗粒物促进肺癌发生发展作用机制的关键,有助于寻找新的特异性防治药物。近日,针对这一点,37000cm威尼斯医药生物技术国家重点实验室(生命科学学院)董磊教授、张峻峰教授团队联合澳门大学王春明团队在肿瘤生物学方向上取得重要进展。
首先,作者分析了FPM暴露后肺癌发生与肺部早期免疫防御的相关性。借助转基因原发性肺癌小鼠模型以及继发性肺癌小鼠模型,作者验证了FPM暴露对于肺癌发生的促进作用。与此同时,对两种肺癌模型在不同发展阶段肺组织中的CTLs进行监测,发现FPM暴露会导致CTLs早期的招募不足,在很大程度上削弱肺组织局部CTLs对肿瘤细胞的杀伤能力。由此可知,FPM所导致的相对宽松的免疫防御环境是颗粒物促进肺癌发生的关键。
接着,该研究分析了FPM如何干预肺组织局部CTLs的浸润与杀伤活性。肺组织在出现肿瘤细胞时,会发出“预警”机制,招募CTLs等免疫细胞。CTLs在肺组织中的迁移主要依赖于细胞外基质提供的路径。通过对CTLs进行实时动态追踪,发现CTLs迁移受阻源于FPM暴露诱发的肺间质结构的改变(图1)。FPM吸入肺组织后,会诱发局部细胞外基质的过度交联,“封锁”以CTLs为主的免疫细胞的迁移路径。当机体出现肿瘤细胞时,受阻的迁移路径会给免疫细胞与癌变细胞的直接接触增加或者设置物理屏障,进而削弱肺组织局部的免疫防御能力(图2)。
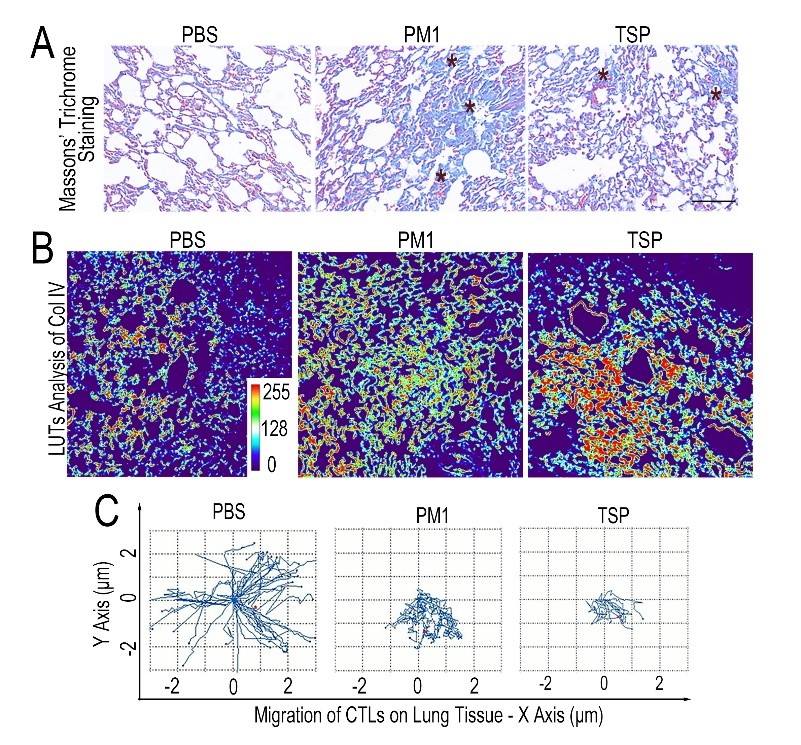
图1. 可吸入细颗粒物(包括雾霾颗粒PM1以及香烟烟雾颗粒TSP)可增加肺组织胶原交联程度(A和B),抑制T细胞迁移(C)。
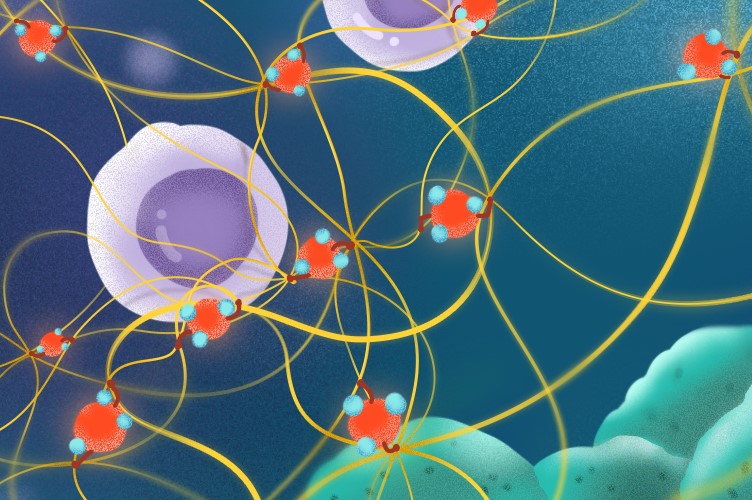
图2.研究整体示意图。可吸入细颗粒物(红色所示)通过“挟持”催化胶原交联的关键酶PXDN(红色表面的分子),诱发细胞外基质交联过度增加(黄色网状结构),抑制杀伤性T细胞(紫色)向肿瘤细胞(湖绿色)迁移并将其清除的能力。
之后,该研究分析了FPM如何影响细胞外基质的交联。通过探究FPM对于细胞外基质交联程度、交联方式和位点的作用,作者发现FPM主要通过增加交联位点硫亚胺键(-S=N-)来发挥作用。FPM的这一生物活性来源于颗粒物进入肺组织后吸附的赖酰过氧化物酶PXDN(图3)。PXDN可特异性催化-S=N-的形成,FPM吸附会显著增加PXDN的酶活,进而提高细胞外基质交联程度。进一步的机制研究表明,PXDN酶活增高与其吸附在FPM表面后从游离状态形成聚集状态的相变过程有关(图4)。之后通过酶与底物分子模拟对接的蛋白质3D建模,发现PXDN的相变可以增加酶和底物反应的接触面,为颗粒物吸附后PXDN酶活的升高提供了有力的理论解释和支持。在确定FPM加速肺癌发生的分子靶点PXDN后,作者尝试利用PXDN的干扰RNA以及小分子抑制剂(间苯三酚;甲硫咪唑)进行预防。上述药物可显著降低FPM暴露后肺癌发生的情况。
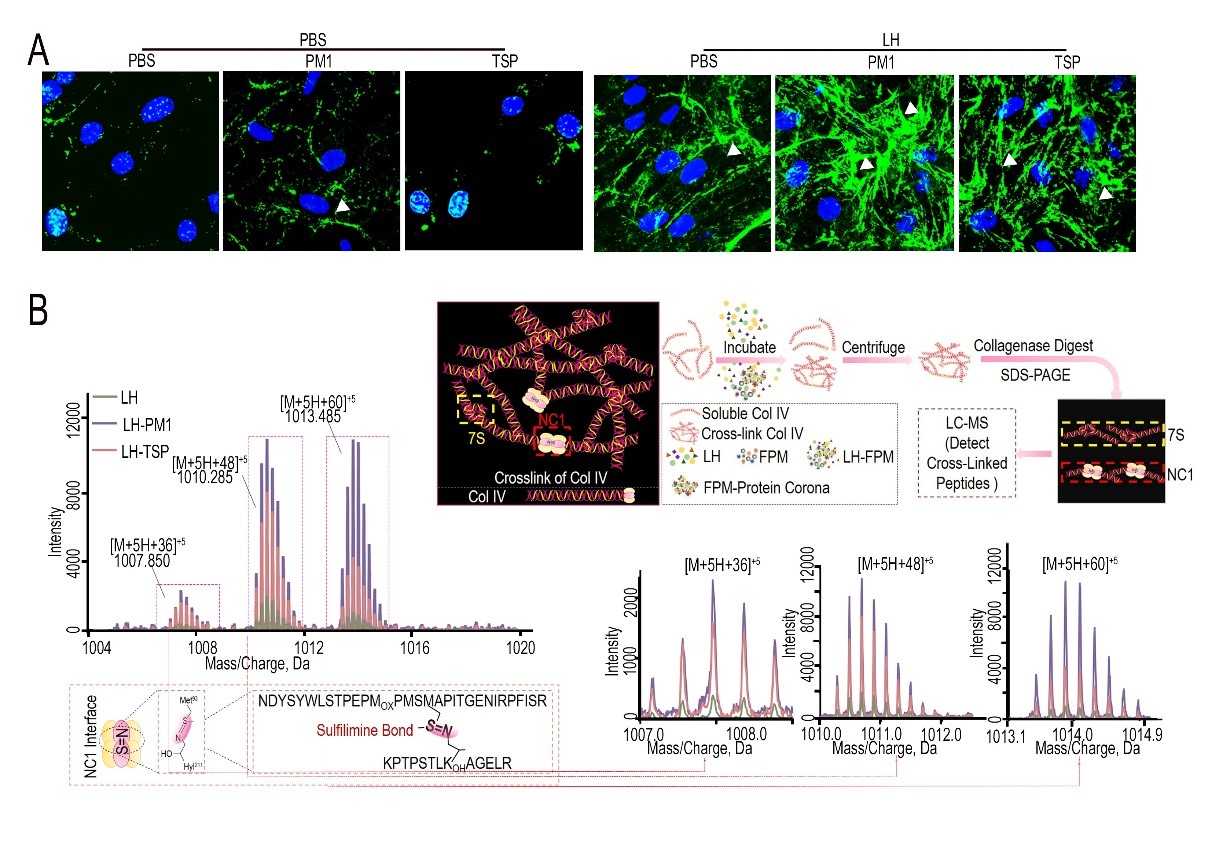
图3.可吸入细颗粒物(PM1和TSP)借助“材料-生物”界面的生物大分子活性参与胶原交联(A),提高交联位点硫亚胺键(-S=N-)的形成(B)。
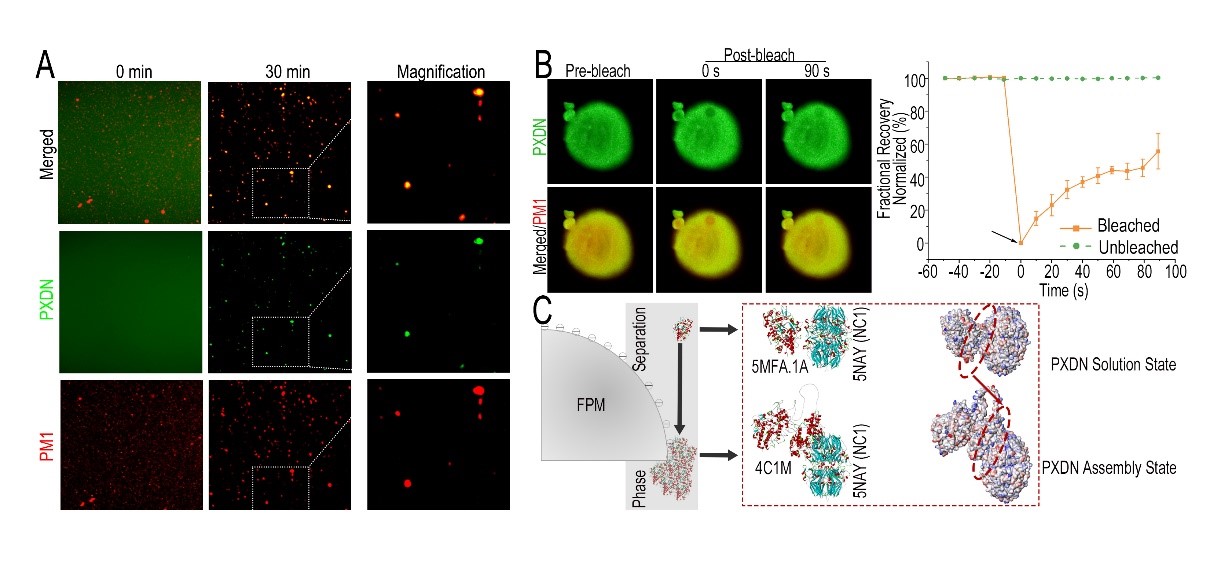
图4.可吸入细颗粒物通过诱导特异性催化-S=N-形成的酶PXDN发生相分离,促使酶从游离状态向聚集状态发生转变(A和B),这一过程理论上可大大提高酶-底物反应的接触面积(C),是颗粒物吸附PXDN后增强其酶活的关键。
综上所述,该研究深入阐明了可吸入细颗粒物在肺癌早期发生过程中的作用机制,明确了这类污染物所诱发的病理变化的关键生物学反应节点,揭示了颗粒物在生物界面对催化反应的调节作用,为颗粒物诱发肿瘤的机制提供了新的解释,并对此提出有效的新型药物治疗分子靶标。
该研究成果以“Air Pollution Particles Hijack Peroxidasin to Disrupt Immunosurveillance and Promote Lung Cancer”为题,于2022年4月19日,在eLife Sciences杂志社出版的生物学领域顶级学术期刊eLife上在线发表。与此同时,杂志社对该文章进行重点新闻报道。生命科学学院王珍珍副研究员为该论文的第一作者,硕士研究生翟子雨、陈春宇,以及博士研究生田雪娇、兴振等参与了该项研究,杨雨顺博士为3D建模提供了大力支持。该工作受到国家自然科学基金、江苏省自然科学基金、教育部中央高校基本科研业务费等的资助。
原文链接:https://prod--journal.elifesciences.org/articles/75345
eLife同期新闻报道链接:
https://prod--journal.elifesciences.org/for-the-press/d29e5b60/how-air-pollution-alters-lung-tissue-increasing-cancer-susceptibility