表皮生长因子(HER)家族的过表达与乳腺癌的发生、发展、转移和耐药过程密切相关,其中HER2在超过20%的乳腺癌细胞表面过表达。多年来,针对HER2靶向疗法的药物包括酪氨酸激酶抑制剂、单克隆抗体和抗体药物偶联体(ADC)等取得了良好的治疗效果,但是更多的证据表明,由于HER家族,包括HER1、HER2、HER3和HER4之间信号网络的相关作用以及和其它分子如整合素的协同作用,HER2单一靶向的治疗效果被极大地限制。因此,开发新型多靶点特异性药物是克服药物响应率低、肿瘤耐药等问题的重要策略。
传统的ADC药物基于全长抗体,药物尺寸较大,在实体瘤中的渗透性较差,而且设计构建双/多特异性抗体的挑战较大。近些年来发展的多肽-药物偶联体(PDC)以多肽分子代替传统抗体,缩小了药物尺寸,增加了药物的渗透性能,但是药物的组织特异性较差,同时体内循环时间较短。针对这些问题,作者团队在前期的研究中提出了重组蛋白药物偶联体(RPDC)的概念(Adv. Mater. 2022, 34, 2109376, doi: 10.1002/adma.202109376)。与传统的ADC药物相比,RPDC的分子尺寸较小,穿透性能较好。另一方面,与PDC药物相比,RPDC的分子尺寸增加,药代动力学行为改善。同时多重靶向的设计使得RPDC药物的靶向特异性提升,显著改善药物的治疗效果。
近日,蒋锡群教授团队提出了一种调控HER家族受体抑制肿瘤生长和转移的策略。他们利用基因工程的方法,将表皮生长因子受体2(HER2)的纳米抗体和整合素的多肽配体RGD融合,构建了一种可以同时靶向HER2和整合素αvβ3两种受体的重组蛋白(RP-HI)和重组蛋白药物偶联体(RPDC-HI)。通过同时阻断肿瘤细胞表面过表达的HER家族和整合素受体,实现了对HER家族及其下游信号的调控,降低了细胞表面EGFR、HER2、HER3和HER4四种受体的表达,阻断了下游PI3K-AKT、SRC的信号传导,显著缩小了肿瘤体积,并抑制了肿瘤转移,最大达到了97.5%的肿瘤抑制率。
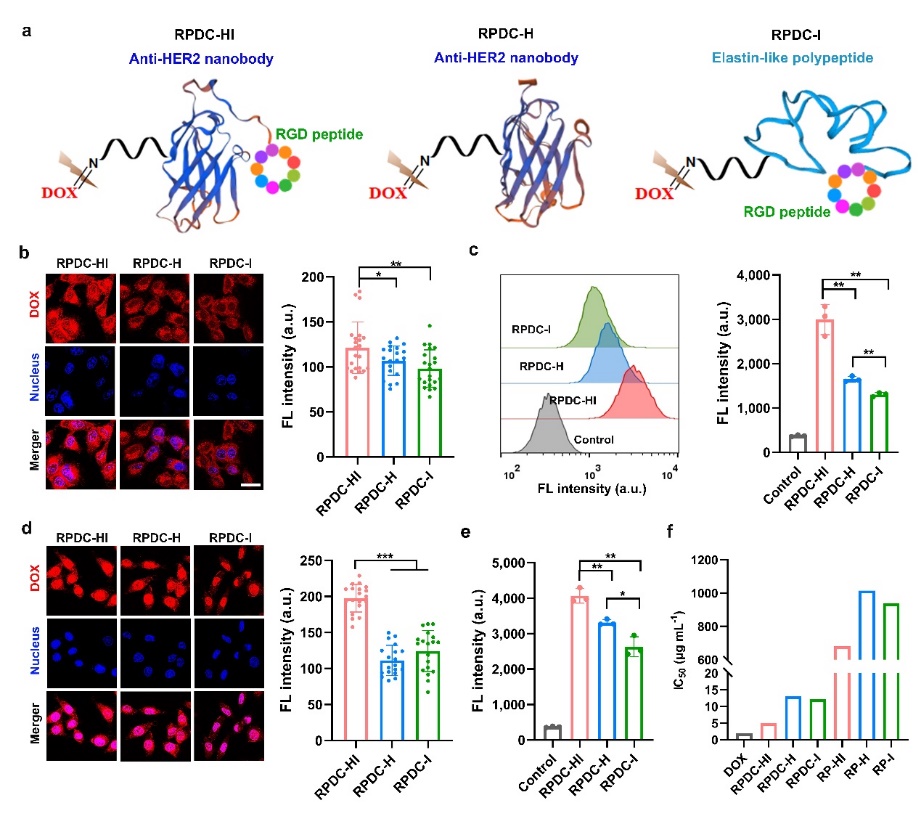
图1. (a)RPDC-HI、RPDC-H和RPDC-I的结构示意图,(b-c)RPDC-HI、RPDC-H和RPDC-I与MCF-7细胞孵育2 h以后细胞摄取的CLSM图像以及细胞核中药物的累积量的半定量分析(b)和细胞中药物累积量的流式定量分析(c),(d-e)RPDC-HI、RPDC-H和RPDC-I与MCF-7细胞孵育4 h以后细胞摄取的CLSM图像以及细胞核中药物的累积量的半定量分析(d)和细胞中药物累积量的流式定量分析(e),(f)DOX和不同RP、RPDC对MCF-7细胞的IC50值。
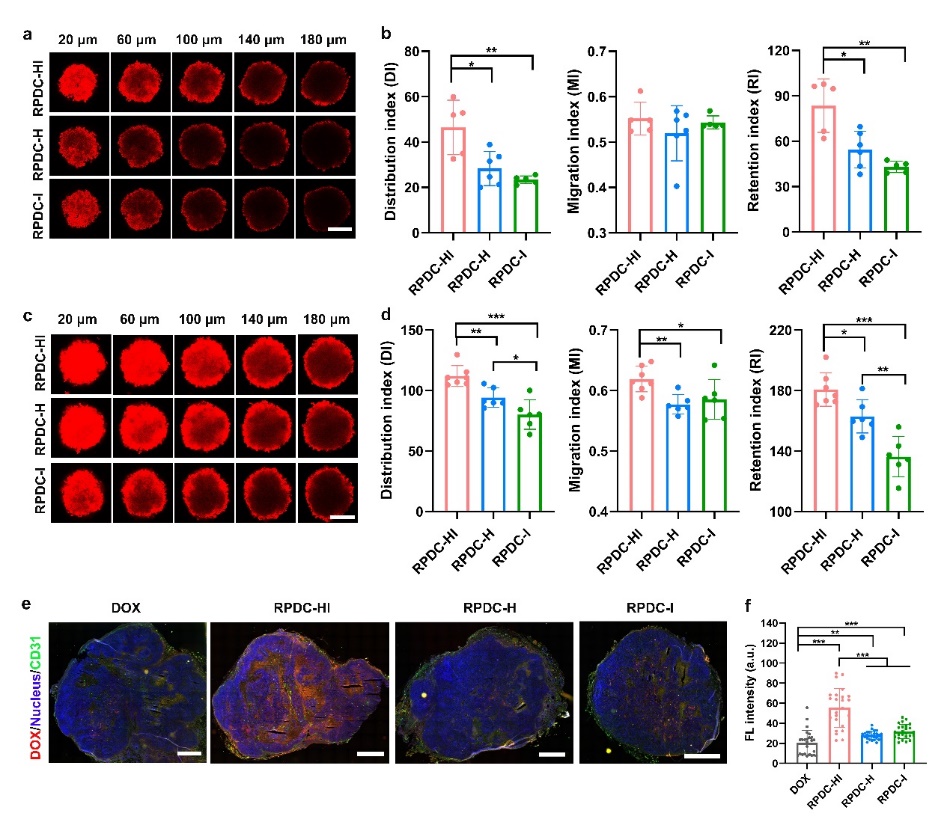
图2. (a-d)不同的RPDCs在MCF-7三维肿瘤细胞球中的渗透情况,(e,f)与裸药DOX相比,不同的RPDCs在大面积的肿瘤组织中的渗透情况。
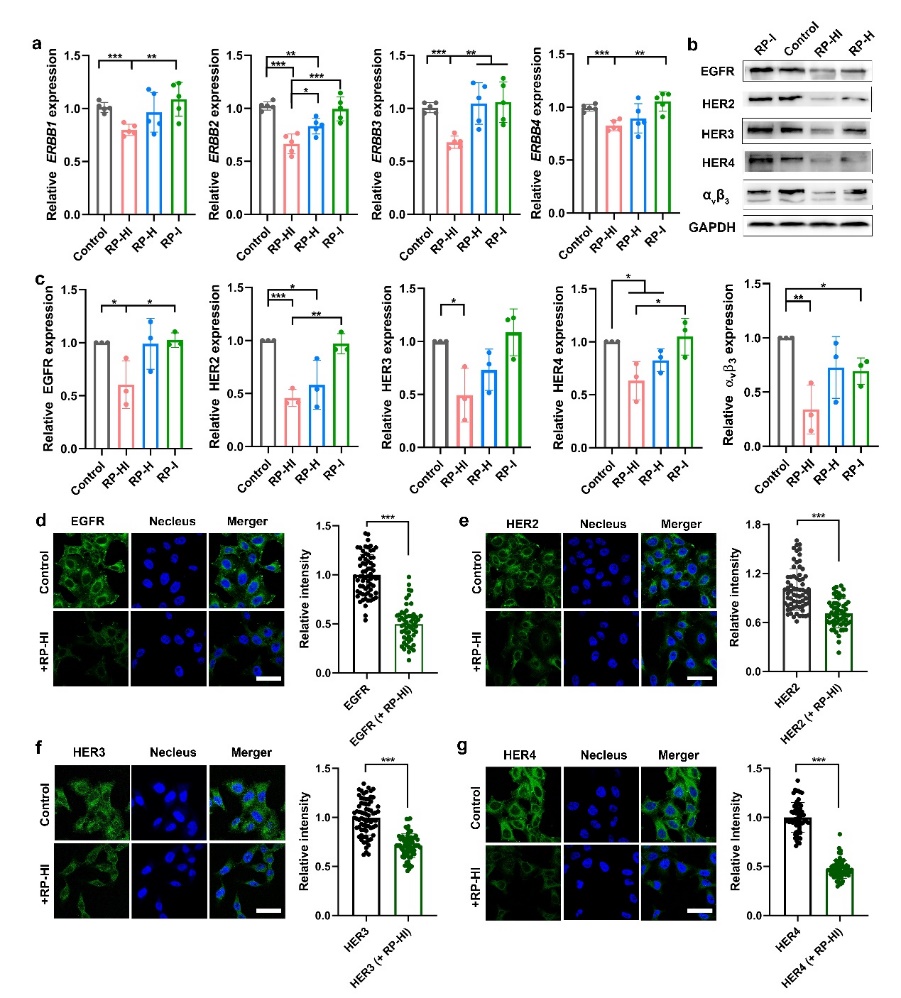
图3. (a)qRT-PCR显示RP-HI对HER受体的mRNA表达水平的调控,(b,c)WB分析RP-HI对HER受体的蛋白表达调控情况,统计结果由ImageJ分析得到,(d-g)免疫染色评估RP-HI处理后的细胞表面的HER受体的含量。
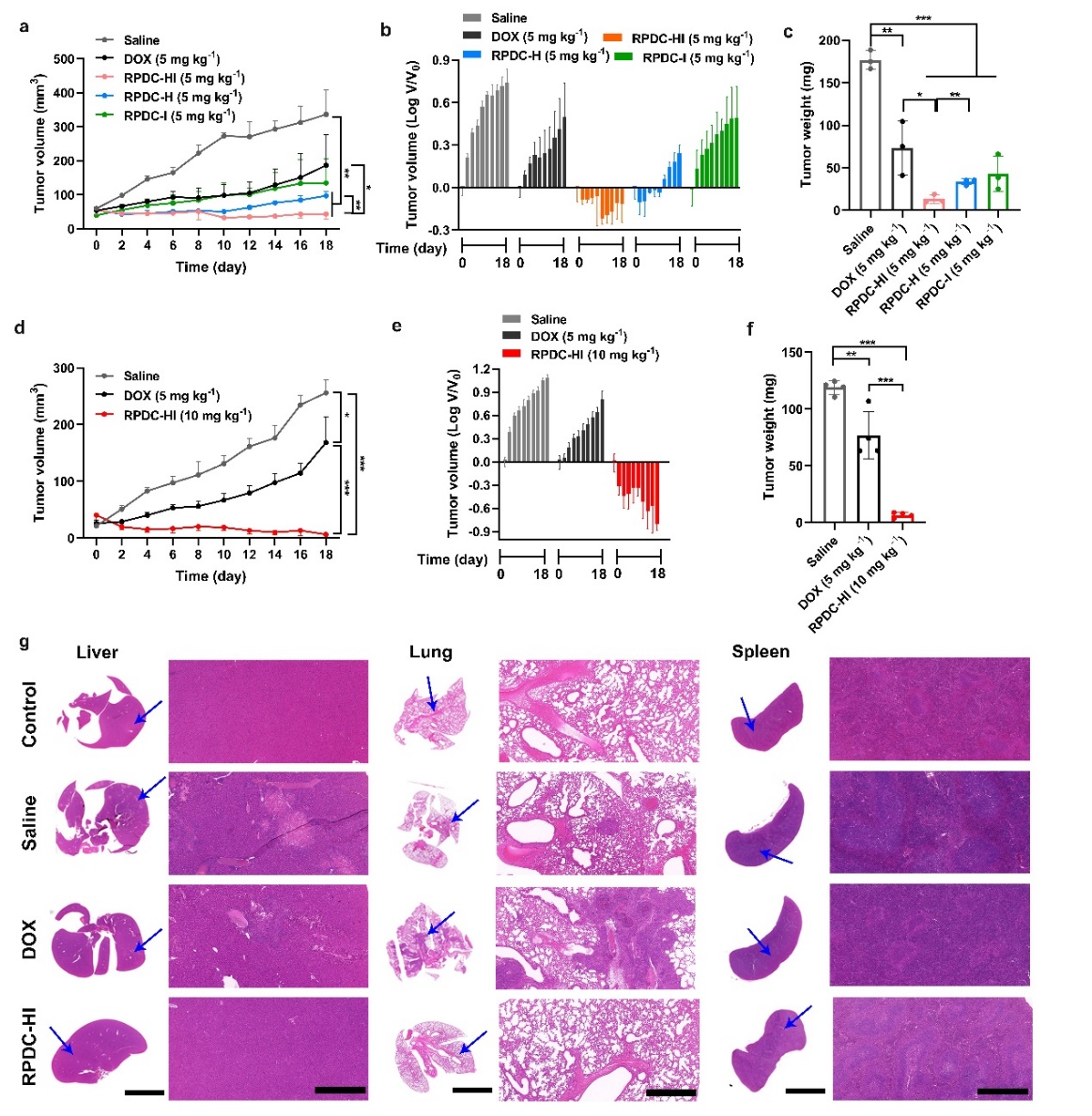
图4. (a-c)不同RPDC于裸药阿霉素在相同剂量(5 mg kg-1)条件下的肿瘤抑制情况,(d-f)提高注射剂量(10 mg kg-1)后的RPDC-HI显著缩小肿瘤体积,(g)不同处理条件下,肝肺组织中肿瘤细胞的转移灶以及脾脏的肿大情况。
上述相关成果已以"Cascade Downregulation of HER Family by a Dual-Targeted Recombinant Protein-Drug Conjugate to Inhibit Tumor Growth and Metastasis"为题在线发表在Advanced Materials刊物上(DOI:10.1002/adma.202201558),37000cm威尼斯博士生袁洋为第一作者,蒋锡群教授和陈伟芝副研究员为共同通讯作者,埃默里大学的毛辉教授对该项工作给与了帮助。该工作获得了国家自然科学基金和江苏省自然科学基金的资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202201558