膀胱癌是泌尿系统最常见的恶性肿瘤之一,依据其发展进程,可分为非肌层浸润性与肌层浸润性膀胱癌两大类,初诊患者中非肌层浸润性膀胱癌约占75%。手术切除是非肌层浸润性膀胱癌的临床主要治疗手段,术后常辅以膀胱内灌注化疗以降低复发率和延缓疾病进程。但是化疗药物可无选择性地进入正常膀胱上皮细胞而产生细胞毒性,同时降低药物的有效作用剂量,减弱治疗效果。为了解决化疗药物的特异性问题,研究者开发了多种基于抗体药物偶联物(ADC)的靶向递送体系,但均为针对肌层浸润性膀胱癌的全身给药治疗,尚未见靶向非肌层浸润性膀胱癌的局部灌注治疗方案。
核酸适体是一类具有结合配体功能的单链核酸分子,可通过体外筛选方式获得。除了具有与抗体相媲美的特异性和亲和力外,核酸适体的突出优势还包括易于合成、易于修饰、免疫原性低等,因而被认为具有治疗多种疾病的潜力。然而,从上世纪90年代核酸适体药物的概念提出至今,全世界仅有一种核酸适体药物获批临床使用;2004年,美国FDA批准Pegaptanib,一种抗VEGF的核酸适体,用于治疗老年性黄斑变性这一眼科疾病。和其它类型的核酸药物类似,适体药物成药性的最大瓶颈在于其体内递送和血液中的稳定性问题。而膀胱癌灌注治疗这一特殊的临床应用场景,因其无需经过体内循环(尿路插管给药),且无特殊的药剂学要求(生理盐水或水均可作为溶剂),可能是一个非常适合核酸适体药物成药的临床适应症。
基于这一理念,生命科学学院闫超课题组与现代工程与应用科学学院于涵洋课题组合作(两位教授均为化学和生物医药创新研究院双聘PI),利用体外筛选方法分离鉴定到能够特异性结合并内化膀胱癌细胞的核酸适体B1,在此基础上开发了核酸适体介导的化疗药物靶向递送系统,并在小鼠膀胱癌原位模型的灌注治疗实验中展现了良好的抗肿瘤效果和药物安全性(图1),给核酸适体药物的成药性带来新曙光。
图1. 基于核酸适体的膀胱癌靶向灌注药物示意图
研究团队首先采用基于细胞的SELEX (Systematic Evolution of Ligands by Exponential Enrichment) 技术,筛选出了能特异性识别内化膀胱癌细胞但不识别正常膀胱上皮细胞的核酸适体。为了提高核酸适体的生物学稳定性,在筛选实验中使用了含2’-氟修饰的嘧啶碱基和2’-脱氧的嘌呤碱基核苷酸。经序列优化后的核酸适体B1具有特异性识别膀胱癌细胞的能力,且能够区分从膀胱癌患者的肿瘤组织与癌旁组织中分离获得的原代肿瘤细胞和正常上皮细胞(图2)。
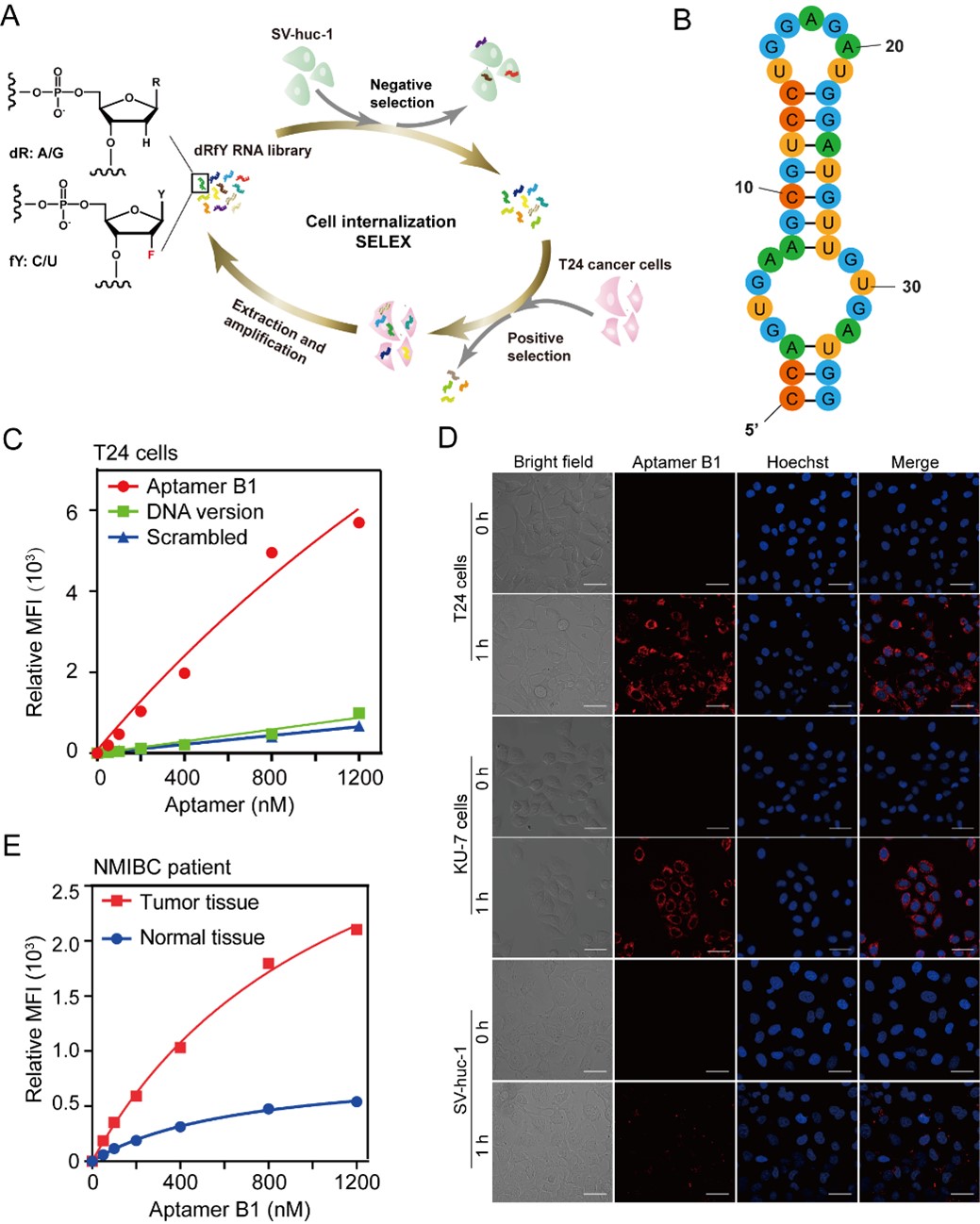
图2. 核酸适体B1特异性内化膀胱癌细胞
临床常用的膀胱癌灌注化疗药物表阿霉素(Epirubicin, EPI),是一种蒽环霉素类药物,可自发嵌入双链DNA的GC碱基对中。考虑到核酸适体B1特异内化膀胱癌细胞的性质,作者设计在核酸适体B1末端偶联一段长DNA双链,形成核酸适体B1为"车头"、长双链DNA为"车厢"的纳米火车结构。结果显示纳米火车依然具有良好的膀胱癌细胞选择性(图3)。
在体外中性条件下化疗药物可稳定内嵌于纳米火车的双链结构中,经内吞作用进入细胞溶酶体后双链DNA被破坏,化疗药物被释放发挥作用。进一步研究发现核酸适体B1介导的靶向递药体系对正常膀胱上皮细胞SV-huc-1的毒性作用明显降低。
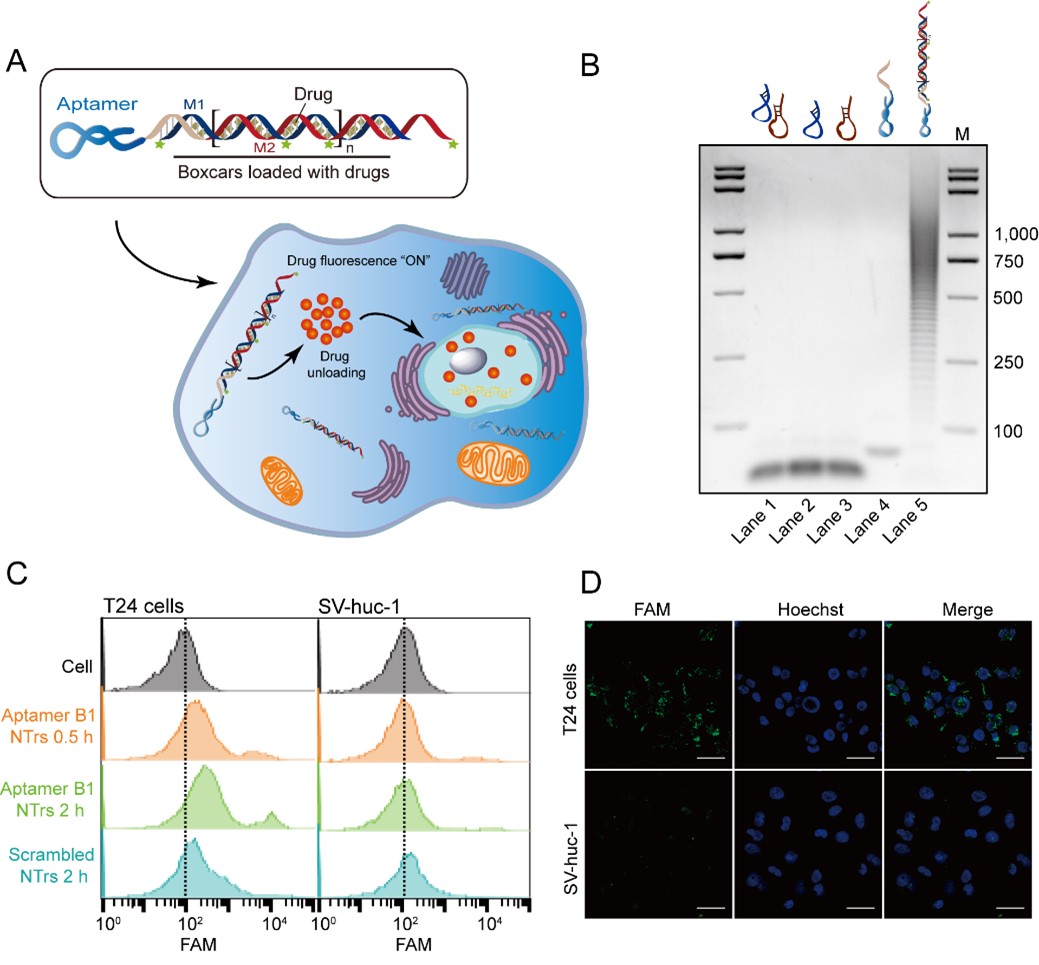
图3. 核酸适体B1介导的纳米火车结构的构建
最后,作者在小鼠膀胱癌原位模型中进行拟临床灌注治疗实验,发现核酸适体B1介导的纳米火车载药体系明显抑制肿瘤的生长,治疗效果显著优于表阿霉素单药,并且显著降低了药物的毒副作用(图4)。
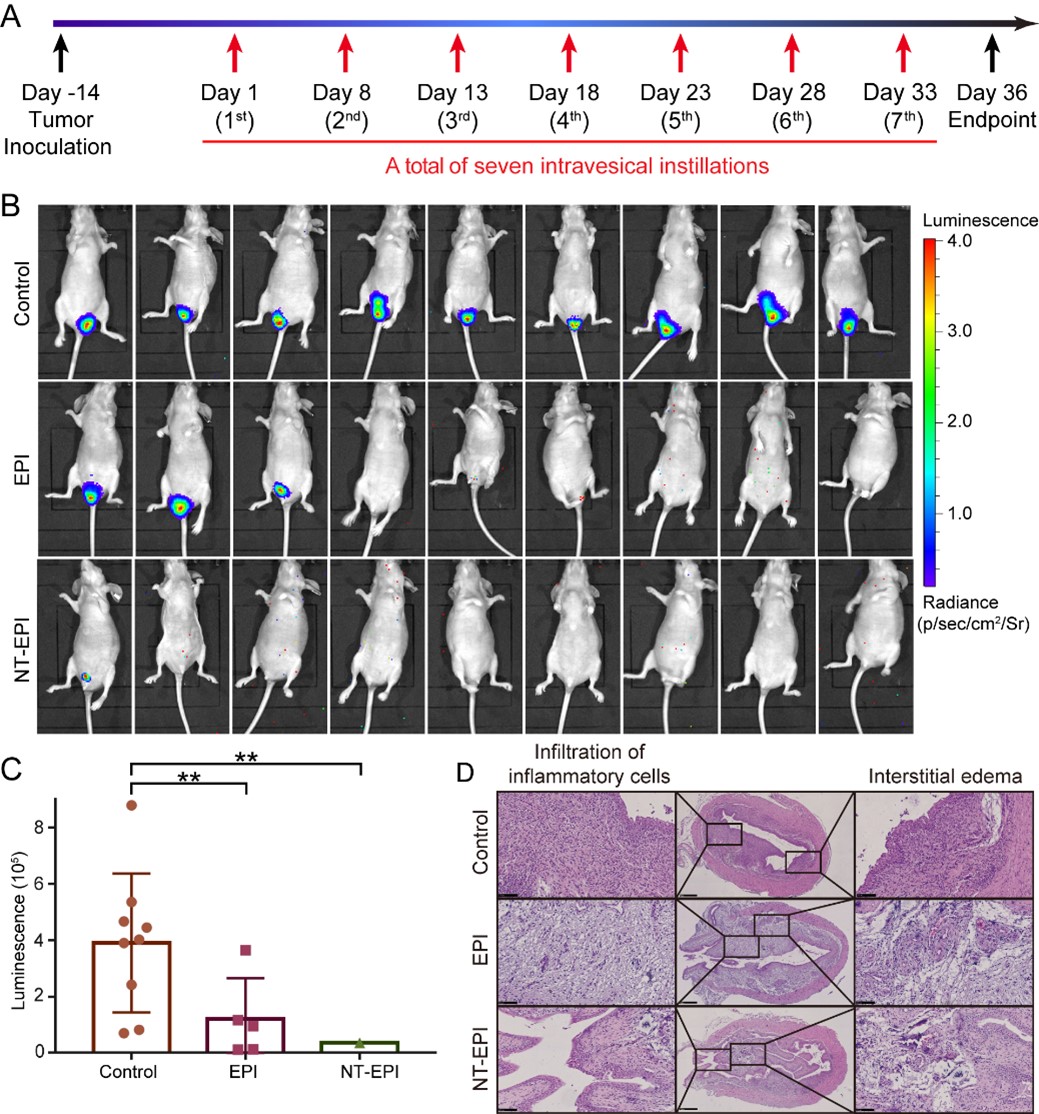
图4. 膀胱癌原位模型灌注治疗效果
该工作首次报道了膀胱癌特异性的核酸适体,并构建了基于核酸适体的纳米火车靶向递药体系,不仅为膀胱癌的临床治疗提供了新的策略,也为核酸适体药物拓展了一个独特的具有极大成药潜力的适应症。
这一成果以Development of novel aptamer-based targeted chemotherapy for bladder cancer为题,2022年3月15日正式发表于37000cm威尼斯学科卓越期刊Cancer Research杂志。现工院已毕业博士生王瑶、生科院博士生张杨、江苏省人民医院泌尿外科李鹏超副主任医师为文章的共同第一作者,美国洛杉矶Cedars Sinai Cancer Center主任Dan Theodorescu教授、37000cm威尼斯于涵洋教授和闫超教授为文章的共同通讯作者,37000cm威尼斯郭佳杰、霍凡、杨锦滔、贾儒、王娟、黄琦菊对该工作亦有贡献。

原文链接:https://aacrjournals.org/cancerres/article/doi/10.1158/0008-5472.CAN-21-2691/675675