37000cm威尼斯医学院蒋青教授研究团队与南京医科大学附属逸夫医院薛斌教授团队、南京医科大学李朝军教授团队、中科院深圳先进院陈棣教授团队合作,发现了慢性肝损伤过程中肝细胞表达PP2Acα调节骨量丢失的分子机制。
肝性骨病(HOD)是一类出现在慢性肝脏疾病患者中的代谢性骨骼疾病,主要表现为骨量丢失、骨密度降低和骨结构的破坏,即肝性骨营养不良。病毒、酒精、药物等外界刺激可引起肝脏的慢性损伤,而肝脏功能的紊乱会通过肝骨轴影响骨代谢平衡,导致骨质疏松和脆性骨折的风险增加。我国有着庞大的慢性肝病患者群体,据报道,2018年中国HBV慢性感染人数预计超过8000万;2016年中国非酒精性脂肪性肝病 (NAFLD)的总病例预计为2.43亿,其中非酒精性脂肪性肝炎(NASH)为3261万例,肝硬化为109万例;此外,中国药物性肝损伤的发生率预计为23.80/10万人甚至更高,发生率仅次于病毒性肝炎及脂肪性肝病。然而,临床对于肝性骨病的重视程度不足,且肝性骨病的治疗尚未有临床指南。肝性骨病患者发生骨折会使得骨骼重建难度提高,严重影响患者生活质量和长期预后,给患者和社会带来巨大的经济负担。目前对于肝性骨病的基础研究较少,因此,阐明肝性骨病的发生和发展机制具有重要的临床意义与科研价值。
该合作团队首先在肝性骨病的临床患者和小鼠模型中发现,肝细胞表达的磷酸酶PP2Acα水平异常升高,而靶向敲除小鼠肝实质细胞中的PP2Acα可以改善HOD小鼠的肝功能,同时缓解骨量的丢失。该团队通过蛋白质组学等手段筛选出了在这一过程中发挥作用的肝源性因子LCAT,并深入研究了PP2Acα通过去磷酸化转录因子USF1抑制下游LCAT表达的作用机制。LCAT作为一种胆固醇转移酶,可将外周组织的胆固醇转移到肝脏中。该团队发现,LCAT通过维持合适的胞内胆固醇水平,起到促进成骨细胞分化和抑制破骨细胞分化的作用,从而调节骨代谢。此外,LCAT还可通过促进胆固醇从骨到肝的逆向转运缓解肝损伤。在慢性肝损伤病程中,肝脏PP2Acα表达异常升高使得下游肝源性因子LCAT水平表达降低,LCAT在骨稳态的维持中具有重要意义,其水平降低可导致骨量丢失,而肝细胞靶向敲除PP2Acα或外源性补充LCAT可逆转这一过程(图1)。
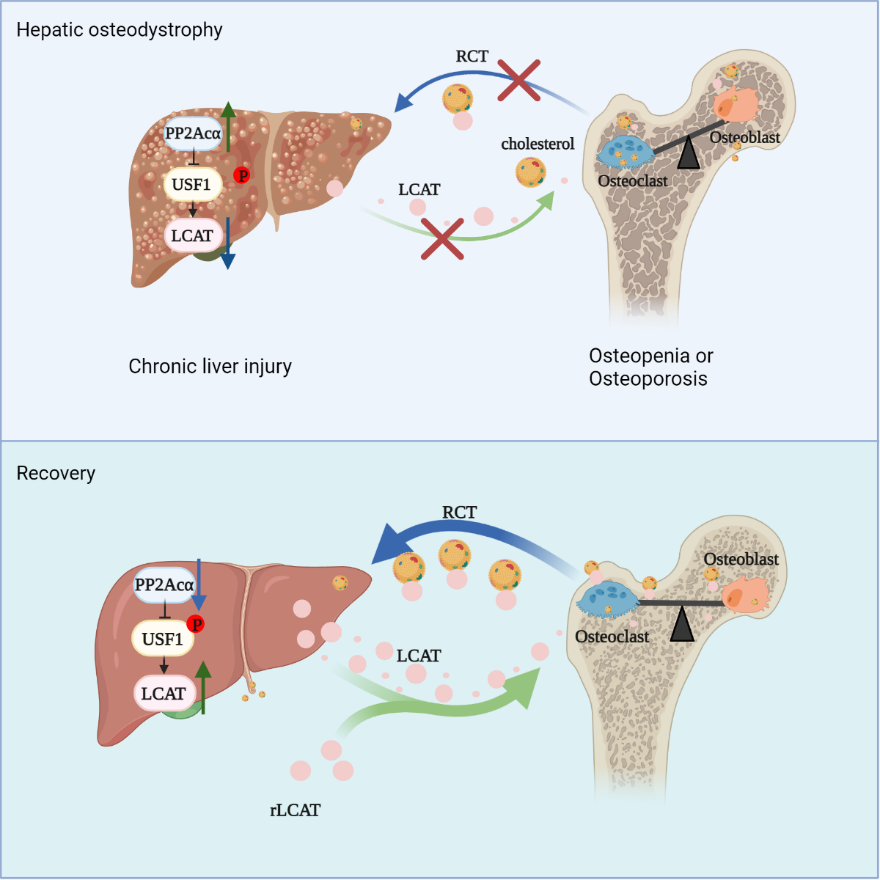
图1
该研究建立并深化了肝/骨轴稳态调控的理论,阐明了肝骨轴失衡加剧了慢性肝损伤导致的肝性骨病的发病机制,筛选出关键的肝骨轴调节分子LCAT,明确了胆固醇逆向转运对于维持肝脏与骨骼稳态的生理意义,也为肝性骨病相关治疗药物的开发提供了潜在靶点,奠定了肝性骨轴稳态调控领域的理论基础。
研究成果以“肝骨轴缺陷促进肝性骨营养不良疾病的进展(Defects in a liver-bone axis contribute to hepatic osteodystrophy disease progression)”为题,于2022年3月1日在线发表于《Cell Metabolism》。文章链接:https://www.sciencedirect.com/science/article/abs/pii/S155041312200050X。陆克博士与石天舒博士为本文共同第一作者。