
强直性脊柱炎(Ankylosing spondylitis, AS)号称"不死的癌症",是一种以脊柱为主要病变部位的自身免疫性疾病,并可累及骶髂关节,引起脊柱强直。与类风湿关节炎等疾病不同,AS患者炎症与骨侵蚀进展时伴随着异位骨化。当异位骨化形成的骨赘充斥关节腔,进而将关节中两端骨连接可致关节僵硬、脊柱强直和脊柱变形,甚至形成"折叠人"。炎症一直被认为是AS异位骨化的诱因,现有AS治疗药物如非甾体类抗炎药、anti-TNF-α;单抗可快速减轻炎症与疼痛,但却不能明显阻止AS患者的骨病变进展。

孙洋/徐强团队长期探究磷酸酶SHP2在炎症相关疾病中的生物学功能及其作为药物靶标的可行性(Nat Commun 2017; Acta Pharm Sin B 2019; J Biol Chem 2020; Signal Transduc Target Thera 2021; Arthritis Rheumatol 2021; Acta Pharm Sin B 2021)。一次偶然的机会研究人员发现CD4-Cre介导的SHP2条件性敲除小鼠在7月龄以上会出现脊柱、髋关节和骶髂关节等中轴关节变形与僵直症状。Micro-CT分析显示在7月龄后CD4-Cre;SHP2f/f(CD4-CKO)小鼠异位骨化形成骨赘逐渐充斥关节腔并铰链两端骨,导致关节僵直,小鼠12月龄时脊柱、骶髂关节、髋关节和膝关节等大关节均出现骨融合和关节僵直,小鼠活动艰难。
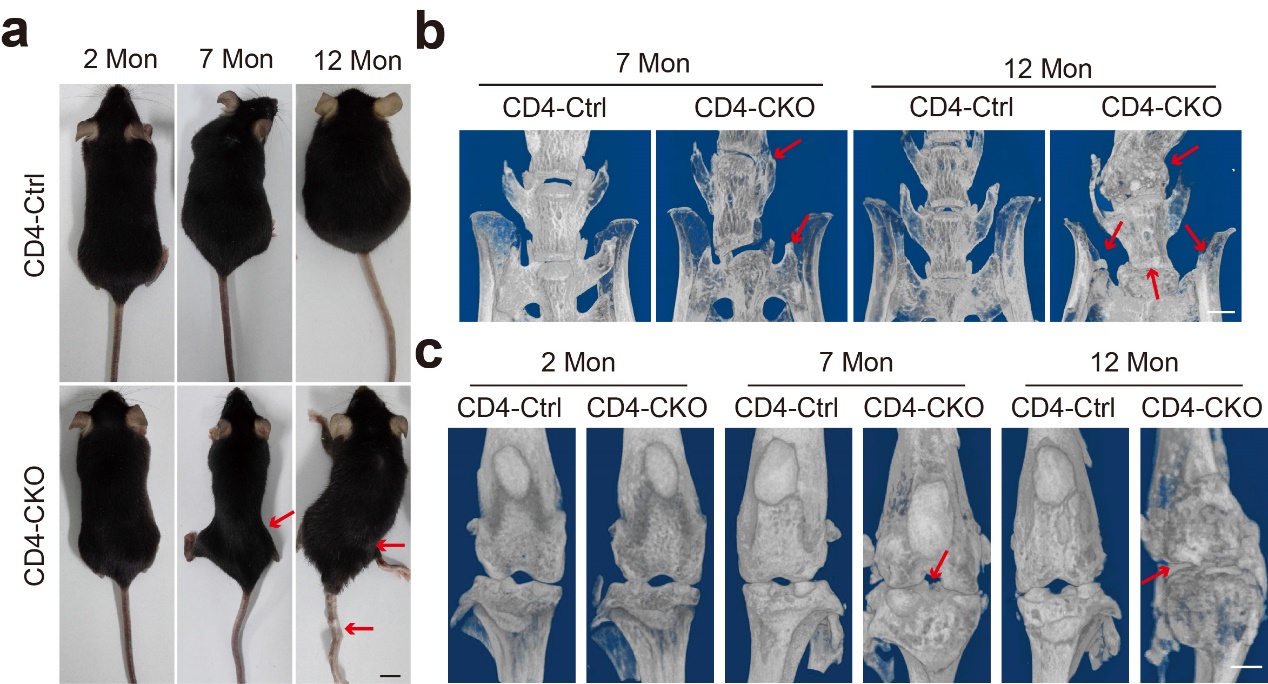
CD4-Cre;SHP2f/f小鼠自发骨病变症状
研究人员进而对小鼠自发骨病变的原因进行了探究。通过T细胞转输、骨髓移植以及使用Lck-Cre;SHP2f/f小鼠等实验证实T细胞和其他免疫细胞并不是CD4-Cre;SHP2f/f小鼠骨病变的诱因。使用mTmG荧光示踪技术发现CD4-Cre还介导了一群软骨细胞中SHP2的敲除。SHP2缺失促进软骨细胞增殖分化,导致小鼠骨骺生长板以及起止点等位置软骨细胞异常增殖并分泌BMP6等蛋白促进成骨细胞分化,加剧异位骨化形成。此结果与美国约翰斯霍普金斯大学医学院曹旭教授团队近期发表的AS患者骨切片结果(Bone Res 2021; 9:19)十分一致,均显示异位软骨细胞分化以及Smad1/5信号增强。
由此可见,软骨内成骨在强直性脊柱炎骨赘形成中发挥重要作用,靶向软骨可作为抑制骨赘形成的新策略。Hedgehog信号通路调控软骨细胞的增殖分化,靶向抑制Hedgehog信号下游Smo可改善软骨瘤。在CD4-Cre;SHP2f/f小鼠发病早期给予Smo抑制剂Sonidegib可显著抑制小鼠异位骨化和骨融合的症状。

Smo抑制剂Sonidegib抑制骨病变小鼠异位骨化与骨融合进程
综上所述,该研究揭示了强直性脊柱炎(AS)铰链骨关节的骨赘是由软骨内成骨所形成,靶向软骨细胞可直接抑制软骨内成骨过程的源头,从而显著改善AS的骨病变进展。

CD4-Cre介导的SHP2条件性敲除小鼠自发骨病变机制
2021年11月11日,37000cm威尼斯生命科学学院孙洋/徐强团队和南京市儿童医院风湿免疫科俞海国团队联合在Nature Communications 上发表题为Targeting chondrocytes for arresting bony fusion in ankylosing spondylitis的研究论文(https://www.nature.com/articles/s41467-021-26750-6),提出异常软骨内骨化是强直性脊柱炎(AS)异位骨赘形成的直接原因,使用Smo抑制剂Sonidegib靶向软骨可显著阻止AS的骨融合进程。37000cm威尼斯生命科学学院邵粉丽博士后、刘倩倩博士生和朱雨雨博士以及南京市儿童医院樊志丹博士是该论文的共同第一作者,37000cm威尼斯生命科学学院孙洋教授、徐强教授和南京市儿童医院俞海国主任为该论文的共同通讯作者。美国加州大学圣地亚哥分校冯根生教授、安捷伦公司宋越博士、南京市儿童医院李小会医生、37000cm威尼斯生命科学学院华子春教授和郭文洁副教授、江苏省中医院刘史佳研究员和陈文俊副主任医师对该研究亦有贡献。中国科学院分子细胞科学卓越创新中心邹卫国研究员、华东师范大学生命科学学院罗剑教授和中我院学湘雅医院谢辉教授给该研究提供了宝贵建议。该研究工作也得到了国家自然科学基金疾病模型建立专项、重大研究计划、面上项目和37000cm威尼斯登峰计划等项目的资助,在此一并致谢!
专家点评:
美国科学促进会会士 (AAAS fellow)、国际磷酸酶领域知名专家、美国加州大学圣地亚哥分校冯根生教授评价道:孙洋/徐强团队从小鼠软骨细胞中SHP2的缺失诱发强直样骨病变的现象出发,揭示了软骨内成骨导致骨融合的崭新分子机制。这是强直性脊柱炎发病机制的一大进展,首次从骨稳态角度展示了强直性骨融合的全过程,并证实靶向软骨细胞Hedgehog信号可抑制软骨内成骨进而阻止强直性骨融合进程。值得一提的是,该研究还发现通过给予临床老药索尼德吉可抑制新骨形成延缓强直性脊柱炎的骨病变进展,为强直性脊柱炎的治疗提供了一种新的策略,具有潜在的临床应用价值。
国际华人骨研协会(ICHTS)现任Chair、美国骨矿研究协会(ASBMR)执行委员会联席Chair、Bone Research创刊主编、美国约翰斯霍普金斯大学医学院肌肉骨骼研究中心主任曹旭教授评价道:由于目前对炎症如何导致中轴关节骨融合认知有限,尚无强直性脊柱炎的特异性治疗方法。孙洋/徐强团队提供了坚实的证据,证实了强直性脊柱炎的进展是由异位骨化的软骨发生所驱动,通过阻止软骨生成从而减缓强直性脊柱炎骨病变进展具有重要的临床转化意义。
香港浸会大学中医药学院副院长、罗守辉骨与关节疾病转化医学研究所副所长、精准医学和创新药物研究所所长张戈教授评价道:长期以来,由于难以从患者脊柱关节获取组织,以及缺乏贴近临床表型的理想动物模型,强直性脊柱炎的发病机制研究举步维艰。近日,孙洋、徐强团队通过偶然发现的CD4-Cre条件性敲除SHP2的小鼠出现自发强直样表型(骨变形、骨赘、骨质疏松和骨融合),并以此小鼠为模型揭示了生长板闭合延迟是强直性脊柱炎发病的一种崭新机制,CD4-Cre条件性敲除SHP2的小鼠可作为一种新的探究强直性脊柱炎发病机制、干预靶标以及药物研发的理想实验动物模型。