纳米材料已经在传感、成像、组学分析和癌症诊疗等领域中得到广泛的应用。特别是量子点、上转换材料、等离激元纳米材料和磁性纳米材料等很多纳米材料由于具有独特的物理响应,能提供高灵敏度的检测信号。然而,这些纳米材料本身缺乏分子识别的能力,其对靶标的识别往往需要利用抗体、凝集素和适配体等生物识别分子对其表面进行功能化。由于这些生物识别分子与纳米材料存在结构和稳定性上的显著差异,这样的表面功能化所赋予的性能往往不甚理想。一个比较理想的解决方案似乎是直接在基底纳米材料的表面通过合理设计和可控合成构建分子识别的功能化材料层。基于此,分子印迹应该是一个最佳的解决方案。
分子印迹是在模板存在的情况下引发功能单体和交联剂的聚合的仿生识别材料制备技术;在除去模板后,得到具有在形状、大小和功能基团与模板相互补的印迹空腔的聚合物。近年来,我校化学化工学院生命分析国家重点实验室刘震教授团队已经发展出多个新颖、通用、高效的分子印迹方法(Angew. Chem. Int. Ed. 2013, 52: 7451; Angew. Chem. Int. Ed. 2015, 54: 10211; Nat. Protocol. 2017, 12: 964; Chem Sci. 2019, 10: 1831),制备出系列蛋白质及其翻译后修饰的仿生识别材料,获得了逼近单克隆抗体和超越于凝集素的分子识别性能,已经应用于亲和分离(Anal. Chem. 2018, 90: 9845; Anal. Chem. 2016, 88: 1447)、疾病诊断(Angew. Chem. Int. Ed. 2014, 53: 10386)、单细胞分析(Angew. Chem. Int. Ed. 2016, 55: 13215.)和癌症治疗(Angew. Chem. Int. Ed. 2019, 58: 10621; Angew. Chem. Int. Ed.2021,60, 2663-2667; ACS Nano, 2021, DOI:10.1021/acsnano.1c07166)等重要领域。
分子印迹技术领域一直存在一个瓶颈问题:为了获得最佳的分子识别性能,需要对功能单体的配比进行优化,但在最佳配比下所得的分子印迹聚合物(MIP)常常无法同时得到最强的亲和力和最高的特异性,而是这两者间的折中。我校刘震教授团队近期提出了先进分子印迹策略—分子印迹和包覆(MIC)(Sci. Bull. 2021, DOI: doi.org/10.1016/j.scib.2021.10.006),所得分子印迹及包覆聚合物(cMIP)同时具备最强的亲和力和最高的特异性,有效地解决了这一长期困扰分子印迹技术的瓶颈问题。在该策略的基础上,近日,该团队报道了一种称为基于反向微乳液的可控表面印迹(ROSIC)的新方法,不仅能对各种纳米材料表面进行仿生分子识别功能化,也能制备无核的分子印迹纳米球,所得材料具有优异的分子识别性能。该技术通过反向微乳液体系体系控制印迹材料的尺寸,并将印迹模板约束在微乳液-水相界面,利用在印迹的过程中水解的硅烷单体会参与纳米材料的表面配体交换,促进将纳米材料引入反向微乳液体系的水相,从而实现对各种纳米材料的表面可控功能化,并在印迹后在非印迹区域精准可控地包覆非特异吸附力若的包覆层。该策略是高效、通用和可控的技术,能制备出识别各种各样的蛋白质及其糖基化和磷酸化等翻译后修饰的纳米材料。该技术可与各种先进纳米技术相结合,在生物传感和生物医学等重要应用领域中具有良好的应用前景。

图1. 纳米材料的表面可控分子印迹

图2. 印迹条件的优化

图3. 在肽段和蛋白水平的特异性考察
通过选择量子点、磁性纳米材料、银纳米材料和上转换纳米材料为代表,作者实现了对各种纳米材料表面进行仿生分子识别功能化的可控分子印迹,制备出了一系列具有单一内核、且尺寸可控的多功能分子印迹及包覆聚合物。作者随后对这种功能化策略的机理进行了深入探讨。
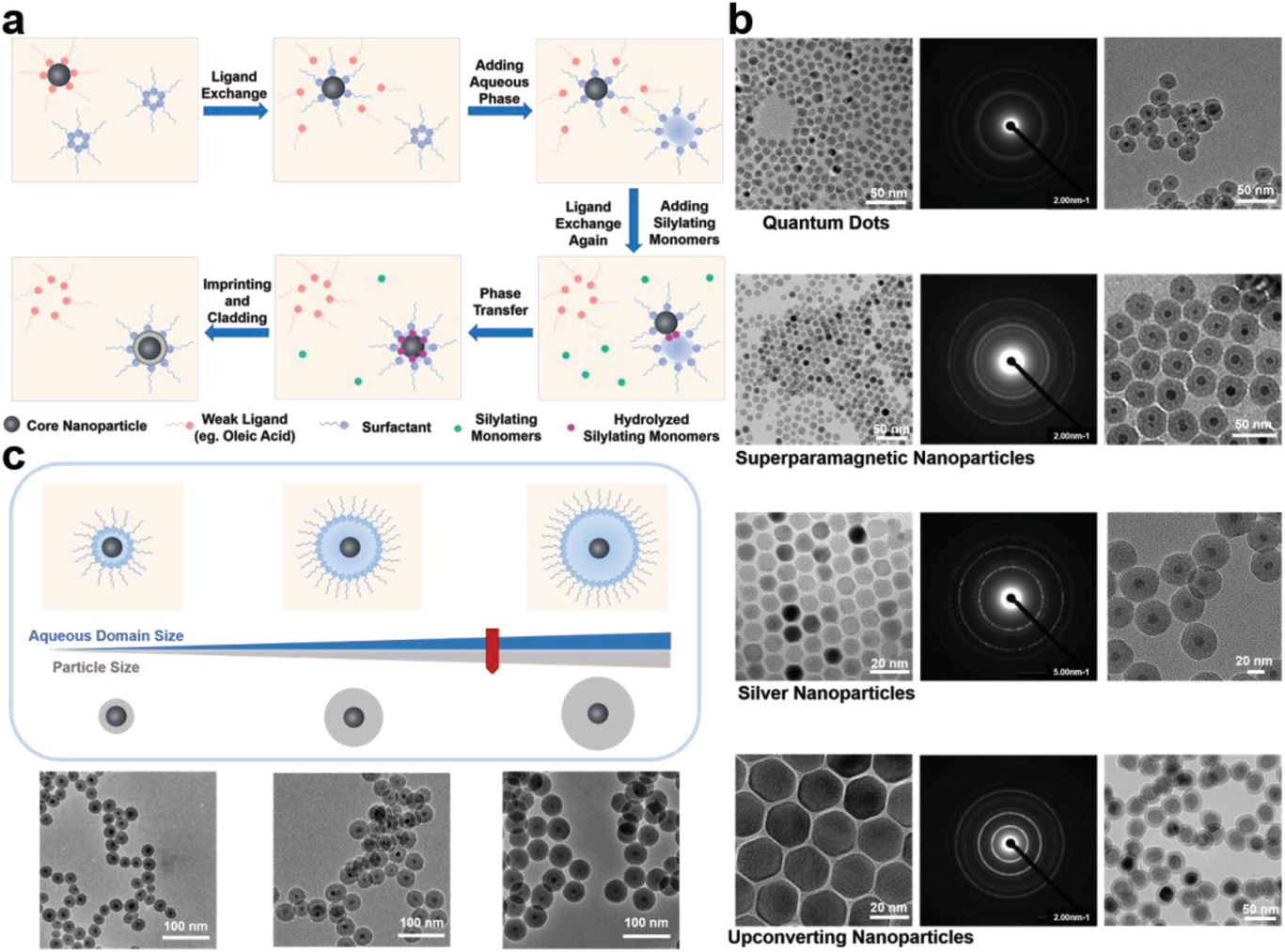
图4. 纳米材料的表面可控分子印迹
为了证明制备的核-壳cMIP在生物医学应用中的潜力,作者制备了单个量子点为内核的分子印迹及包覆聚合物(QD@cMIP NPs),针对两种典型的癌症生物标志物,包括人类表皮生长因子受体-2(HER2)和跨膜糖蛋白非转移基因B(GPNMB),进行靶向识别,并通过共聚焦荧光成像实现了三阴性乳腺癌(TNBC)细胞与其他乳腺癌细胞系的区分。

图5. 人乳腺癌细胞荧光共聚焦成像。
最后,作者通过对荷瘤小鼠模型进行体内靶向成像,进一步证明了其实际应用价值。

图6. 活体成像。
综上所述,该工作所提出的ROSIC策略可以成功用于纳米材料的表面可控分子印迹,实现对肽段和蛋白的靶向。印迹过程所需的模板可以很容易地通过固相合成获得,避免了模板昂贵和难以制备等问题。此外,这种方法可用于靶向其它具有生物学意义的化合物,如聚糖。因此,本研究为具有靶向能力的先进纳米材料的设计和功能化开辟了新的途径,在生物医学应用中具有广阔的前景。
这一成果近期发表在Advanced Science上,文章的第一作者是博士研究生郭展辰,刘震教授为论文的通讯作者。该研究得到了国家自然科学基金重点项目和37000cm威尼斯卓越计划的经费资助。
论文信息:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202101713
Controllable Engineering and Functionalizing of Nanoparticles for Targeting Specific Proteins towards Biomedical Applications
Zhanchen Guo, Rongrong Xing, Menghuan Zhao, Ying Li, Haifeng Lu, and Zhen Liu *
Advanced Science 2021, DOI: 10.1002/advs.202101713