结肠癌属于消化道常见恶性肿瘤,主要来源于结肠上皮组织,发病率和死亡率均居全球癌症前三,临床上迫切需要新的预测标志物和有效的治疗策略。结肠癌可分为微卫星稳定(MSS)和微卫星不稳定(MSI)两种亚型,后者一般表现出更多的免疫浸润以及更好的预后。
近年来,蛋白酪氨酸磷酸酶SHP2一直是人类疾病特别是癌症领域的关注焦点。多家跨国制药公司如诺华、Revolution Medicines/赛诺菲、加科思/艾伯维的SHP2抑制剂相继进入I/II期临床试验阶段,用于多种实体瘤的治疗。目前的研究表明,SHP2在肿瘤细胞和肿瘤微环境中同时发挥着重要的调控作用,但详细作用机制仍有待阐明。
为更全面地阐明正处于临床试验阶段SHP2变构抑制剂抗实体瘤的分子机制,研究人员利用单细胞转录组测序技术对SHP2变构抑制剂SHP099重塑小鼠MC38结肠癌移植瘤模型中的肿瘤微环境进行了全景展示。他们发现SHP2变构抑制剂SHP099可以显著阻滞肿瘤细胞的恶性演变,并且SHP099激活了SHP2所抑制的STING-TBK1-IRF3介导的I型干扰素信号,使浸润的但受到抑制的髓系细胞重新被激活。与此同时,研究人员对23例临床结肠癌样本(19例MSS型;4例MSI-H型)单细胞测序结果进行分析发现,T细胞、髓系细胞和上皮样细胞中的PTPN11(SHP2编码基因)与I型干扰素通路下游基因的表达呈显著负相关。值得注意的是,在恶性程度较高的“免疫沙漠”型微卫星稳定(MSS)结肠癌患者中,这三类细胞的PTPN11表达明显高于低恶性的微卫星高度不稳定(MSI-H)型。最后研究人员借助临床结肠癌不同分型组织切片发现,与预后良好的MSI-H型相比,MSS型患者表现出更多的巨噬细胞浸润且伴随更强的SHP2激活,进一步确证了巨噬细胞中的SHP2在结肠癌免疫抑制微环境形成中发挥重要作用。
综上所述,该研究揭示了一种由SHP2介导的结肠癌免疫逃逸新机制,即SHP2在巨噬细胞中抑制STING-TBK1-IRF3通路进而下调I型干扰素信号促进肿瘤免疫逃逸,靶向抑制SHP2可上调I型干扰素信号进而重塑肿瘤微环境实现对结肠癌的治疗。
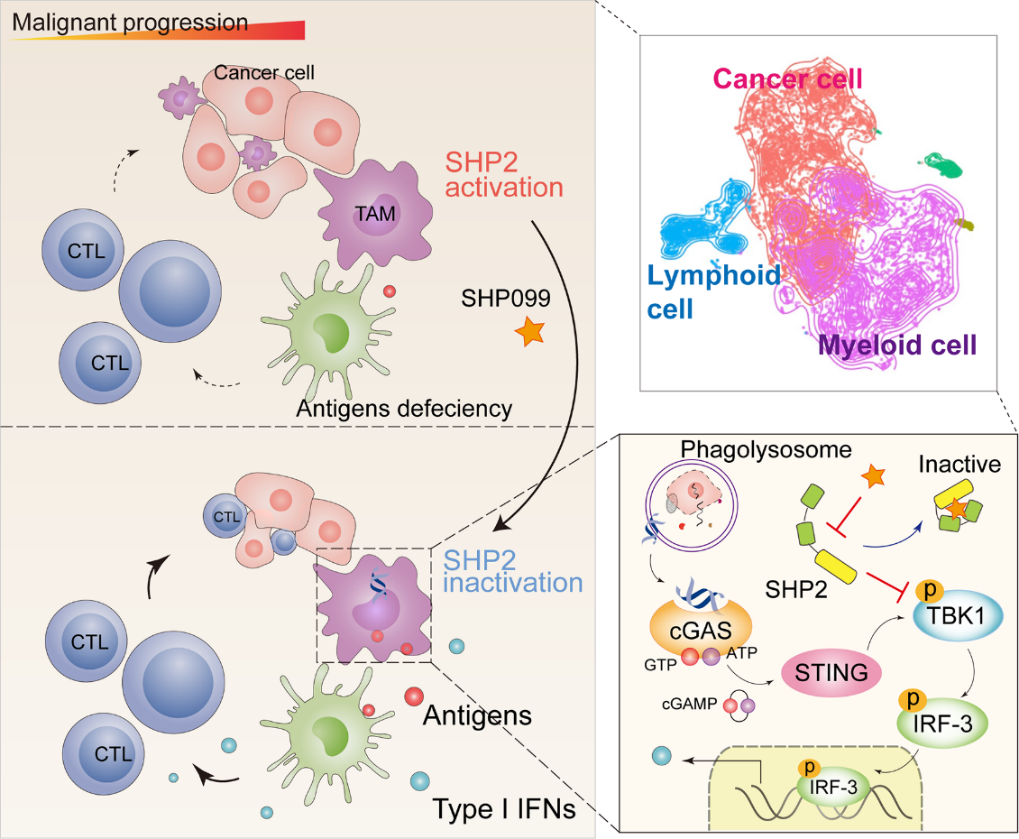
SHP2在巨噬细胞中抑制STING-TBK1-IRF3通路进而下调I型干扰素信号促进肿瘤免疫逃逸
该成果以Allosteric inhibition reveals SHP2-mediated tumor immunosuppression in colon cancer by single-cell transcriptomics为题于2021年8月11日在中国科技期刊卓越行动计划领军期刊Acta Pharmaceutica Sinica B(1区,IF:11.413)在线发表(https://doi.org/10.1016/j.apsb.2021.08.006)。37000cm威尼斯生命科学学院高健副研究员、吴志桂硕士生和赵明霞博士是该论文的共同第一作者,生命科学学院孙洋教授、陈迪俊副教授、徐强教授和上海市第六人民医院陈红旗副主任医师是该论文的共同通讯作者,该研究工作也得到了国家自然科学基金重点项目、重大研究计划和37000cm威尼斯登峰计划等项目的资助,在此一并致谢!