引起发热伴血小板减少综合征的新型布尼亚病毒SFTSV属于布尼亚病毒科(Bunyaviridae)白蛉病毒属(Phlebovirus)。发热伴血小板减少综合征临床表现主要为发热、血小板和白细胞减少、胃肠道症状以及淋巴结肿大等。其中重症患者可因多器官衰竭而死亡,病死率高达10-30%。该病毒目前在我国部分地区和日本韩国等几个东亚国家流行;此外,在美国、印度和澳大利亚也发现了在进化上与SFTSV非常接近的病毒,如Heartland virus等,提示SFTSV和SFTSV样的病毒对全球健康的威胁。
SFTSV感染的重症化与固有免疫和适应性免疫的缺失具有非常显著的关系。37000cm威尼斯吴稚伟教授团队之前的研究揭示,在SFTSV重症病人伴随着非常显著的IFN-β缺陷和体液免疫缺陷。这提示病毒可能通过抑制宿主I型干扰素的产生来形成固有免疫缺陷,从而创造更利于病毒复制和扩散的感染环境(1)。本次报道的该团队最新研究发现,病毒的NSs非结构蛋白在I型干扰素固有免疫调节中起作用。NSs结合干扰素通路起点处重要的RNA感受器分子LSm14a (RAP55),并抑制LSm14a与RIG-I的结合和IFN通路的启动。这项发现已经在最新一期的Journal of Immunology期刊发表(2)
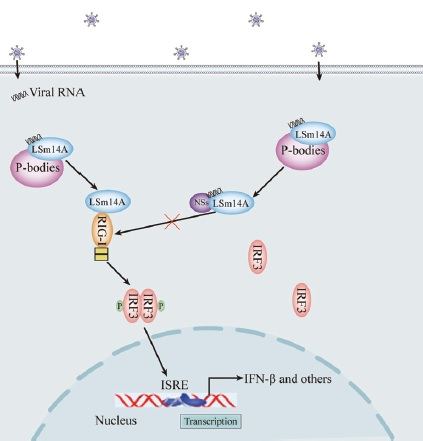
新型布尼亚病毒的NSs蛋白与LSm14a结合并阻断干扰素通路的启动
研究者构建NSs表达质粒并转染细胞,通过标签抗体捕获和质谱分析发现NSs与细胞内的LSm14a结合。同时,免疫荧光分析发现SFTSV感染中,NSs蛋白与细胞内LSm14a发生共定位。这些现象提示NSs非结构蛋白可能通过与干扰素通路起点处的RNA感受器分子相互作用来抑制宿主干扰素产生。
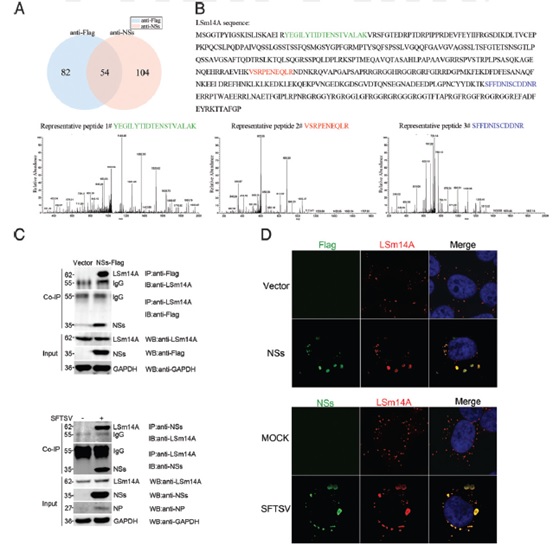
病毒的NSs非结构蛋白直接与宿主细胞LSm14a结合
进一步分析发现,NSs蛋白的N末端存在一个LRRD基序,与它和LSs14a的结合过程中发挥关键作用。尤其是该序列中的第二个精氨酸(R35)的变异可以直接消除NSs与LSm14a的结合和它对IFN-β的抑制。
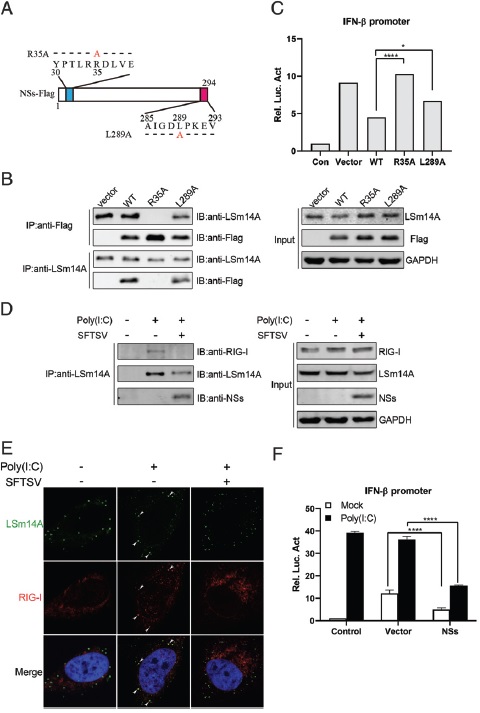
LRRD基序在NSs与宿主LSm14a分子及干扰素抑制中起重要作用
研究者还发现,NSs与LSm14a的结合并未影响LSm14a分子对病毒RNA的结合和感知。来自病毒的NSs分子和来自宿主的LSm14a分子均与病毒核酸发生了结合。
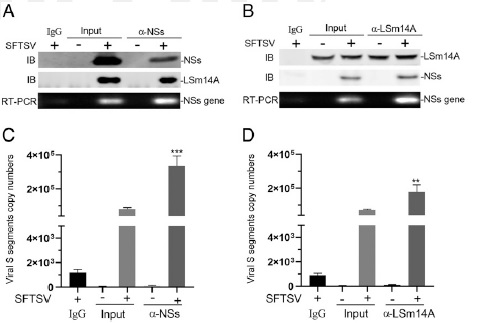
病毒RNA与LSm14a和NSs蛋白复合物结合
综上所述,此项研究证实了LSm14a介导的IFN-β反应对RNA病毒感染的限制作用。更值得重视的是,研究结果发现了新型布尼亚病毒非结构蛋白通过与LSm14a分子直接结合并干扰其与RIG-I的相互作用,从而干扰IRF3磷酸化和下游IFN-β反应。
参考文献
Song P, Zheng N, Zhang L, Liu Y, Chen T, Bao C, Li Z, Yong W, Zhang Y, Wu C, Wu Z. Downregulation of Interferon-β and Inhibition of TLR3 Expression are associated with Fatal Outcome of Severe Fever with Thrombocytopenia Syndrome. Sci Rep. 2017 Jul 26;7(1):6532. doi: 10.1038/s41598-017-06921-6. PMID: 28747721; PMCID: PMC5529500.
Zhang L, Fu Y, Zhang R, Guan Y, Jiang N, Zheng N, Wu Z. Nonstructural Protein NSs Hampers Cellular Antiviral Response through LSm14A during Severe Fever with Thrombocytopenia Syndrome Virus Infection. J Immunol. 2021 Jul 9:ji2100148. doi: 10.4049/jimmunol.2100148. Epub ahead of print. PMID: 34244294.