
嵌合抗原受体修饰的T细胞(CAR-T)免疫疗法在临床B细胞淋巴瘤白血病治疗中已经取得显著疗效。然而,CAR-T细胞疗法必须遵循个体化治疗策略,历经个体细胞体外分离、扩增、CAR-T细胞构建以及回输体内等复杂治疗过程,造成CAR-T治疗周期长(十天以上)、费用昂贵(百万以上)等明显缺点。因此,虽然目前CAR-T已获准上市,但仍然难以实现规模化,不宜于推广应用。而临床急需一种基于CAR分子的更便捷、更高效的免疫疗法。鉴于以上背景,37000cm威尼斯医学院吴稚伟教授课题组创造性的提出了AAV介导CAR分子基因治疗(AAV-mediated in vivo CAR gene therapy,ACG)的新方法,并完成了概念论证与疗效评估。
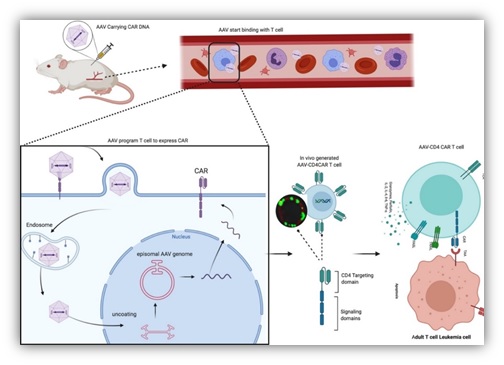
AAV介导CAR分子的基因治疗(ACG)示意图:携带有CAR分子的AAV注射进小鼠腹腔内,并直接感染T细胞,从而在T细胞表面表达CAR分子,形成CAR-T细胞,进而发挥CAR-T细胞特异性杀伤功能。
该方法借鉴前期AAV递呈双靶向抗体治疗HIV感染的工作基础(Xilin Wu, et al., JCI, 2018),推测具有高效广谱感染活性的重组AAV病毒可以携带CAR分子在体内直接感染T细胞,从而形成CAR-T细胞。在实践中,课题组应用重组AAV携带CAR分子,将带有CAR分子的AAV-CAR病毒直接注射到体内,成功实现了AAV-CAR对T细胞的体内感染,形成了CAR-T细胞。为了验证体内形成的CAR-T细胞的杀伤功能,课题组选取针对CD4的抗体作为CAR分子,构建了AAV-CD4-CAR,注入人源化NCG-HuPBL小鼠构建的肿瘤模型中。结果显示,单一注射AAV-CD4CAR分子25天后,小鼠体内的CD4+肿瘤细胞基本消失。同时ex vivo实验结果也显示,AAV-CD4CAR能特异性杀伤来自成人T细胞白血病(ATL)患者的CD4+肿瘤细胞。综合实验结果,课题组证实AAV介导的CAR分子基因治疗(AAV-mediated in vivo CAR gene therapy,ACG)能够在体内发挥特异性杀伤功能,从而达到类似传统CAR-T细胞治疗的效果。ACG治疗的关键是AAV-CAR病毒载体,可以实现体外的规模化制备,然后通过体内直接注射来实现CAR-T细胞的体内生成,从而大大简化了传统CAR-T细胞的制备流程,为CAR细胞治疗提供了一种更便捷、更高效的新型治疗策略,并大大降低了治疗成本。
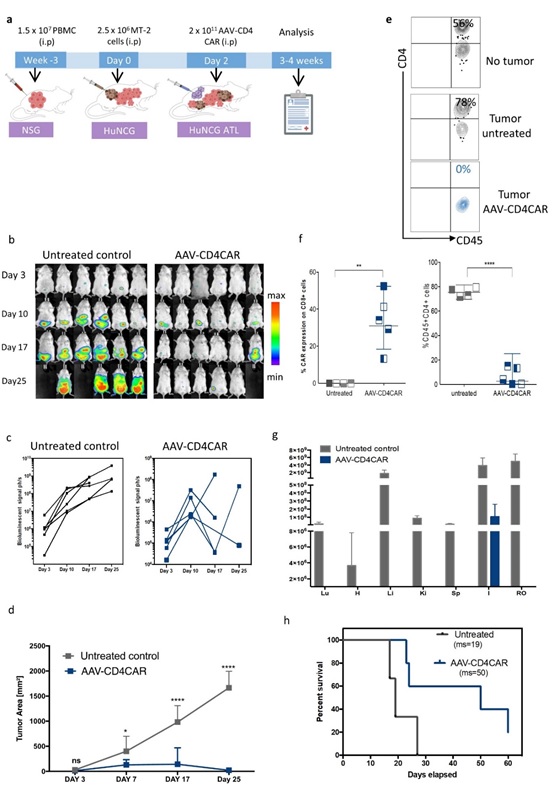
体内产生的AAV-CD4 CAR T细胞介导抗肿瘤活性。用2.5 x 106 表达荧光素酶的MT2 ATL 细胞接种 NCG-HuPBL 小鼠造模。肿瘤细胞接种48小时后,给小鼠注射2 x 1011 携带CD4 CAR基因的AAV。PBS作为阴性对照。
上述研究以“AAV-Mediated In Vivo CAR Gene Therapy for Targeting Human T Cell Leukemia”为题于2021年6月23日发表在Blood Cancer journal (https://www.nature.com/articles/s41408-021-00508-1)。37000cm威尼斯博士生Waqas Nawaz为该论文第一作者,37000cm威尼斯医学院吴稚伟教授和吴喜林特任副研究员为本文通讯作者。该研究得到了国家自然科学基金、“十三五传染病重大专项”基金、江苏省六大人才高峰、江苏省双创博士等项目的支持。