膳食果糖摄入量的增加被认为是代谢综合征的主要诱因之一,可导致肾小球足细胞损伤和蛋白尿产生。线粒体作为维持细胞生物能量稳态和糖异生的关键细胞器,其损伤有可能与肾小球肾病发生发展有关。然而,在高果糖诱导肾小球足细胞损伤过程中线粒体功能障碍的机制尚需探索。
在该研究中,作者利用定量蛋白质组学策略来全面表征高果糖饮食诱导大鼠肾小球足细胞损伤进展的动态变化(建模16周),发现长期高果糖摄入可驱动肾小球线粒体代谢重编程(包括三羧酸循环、脂肪酸降解和氧化磷酸化)。与正常组相比,在建模第4周开始观察到大鼠肾小球中的脂质积累,同时可检测到肾小球足细胞线粒体肿胀;而在建模第8和12周,肾小球足细胞线粒体数量、基质密度和嵴数量均减少;尤其在第12周后,观察到肾小球足细胞出现嵴破裂和消融及线粒体超微结构严重破坏。
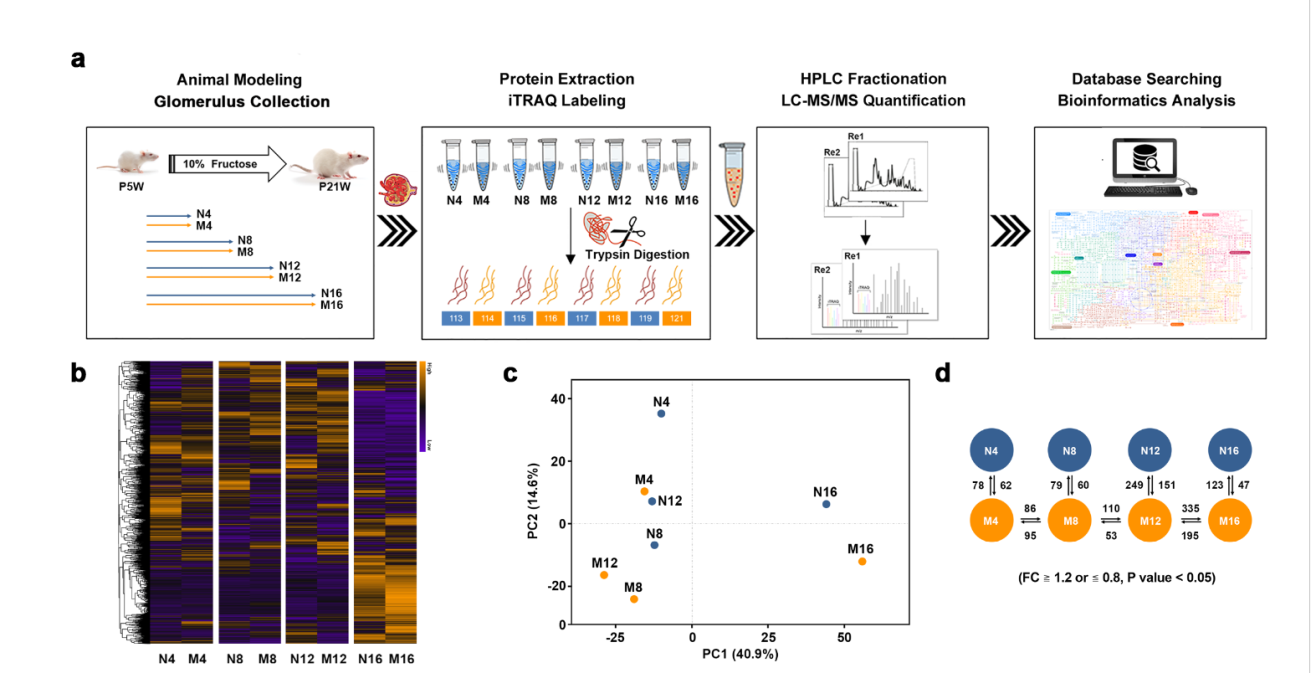
长期高果糖喂养大鼠模型的建立及其肾小球的定量蛋白质组学表征
重要的是,与正常组相比,酮体生成的核心限速酶3-羟基-3-甲基戊二酰辅酶A合酶2(Hmgcs2)在建模第8周开始显著增加。然而,在Hmgcs2小干扰RNA(siRNA)转染的分化足细胞和肾特异性Hmgcs2敲低小鼠的肾小球中,β-羟基丁酸(3-HB)水平降低并且组蛋白去乙酰化酶(HDAC)活性显著提高,而组蛋白H3和H4的乙酰化显著下调。这些结果表明Hmgcs2调控3-HB以影响脂肪酸降解相关酶变化,从而导致在高果糖诱导足细胞损伤过程中线粒体失调。出乎意料的是,该研究还发现通过RNA干扰敲低Eci1或Eci2可显著抑制足细胞模型中Hmgcs2增加,提示酮体生成中关键酶的表达可能受脂肪酸降解途径的调控;而Eci1或Eci2的下调可有效逆转高果糖诱导的足细胞线粒体功能障碍。因此,该研究揭示了一种表观遗传修饰介导的正反馈机制,其中包含酮体生成和脂肪酸降解,及其在高果糖诱导的足细胞损伤过程中调节线粒体代谢重编程。
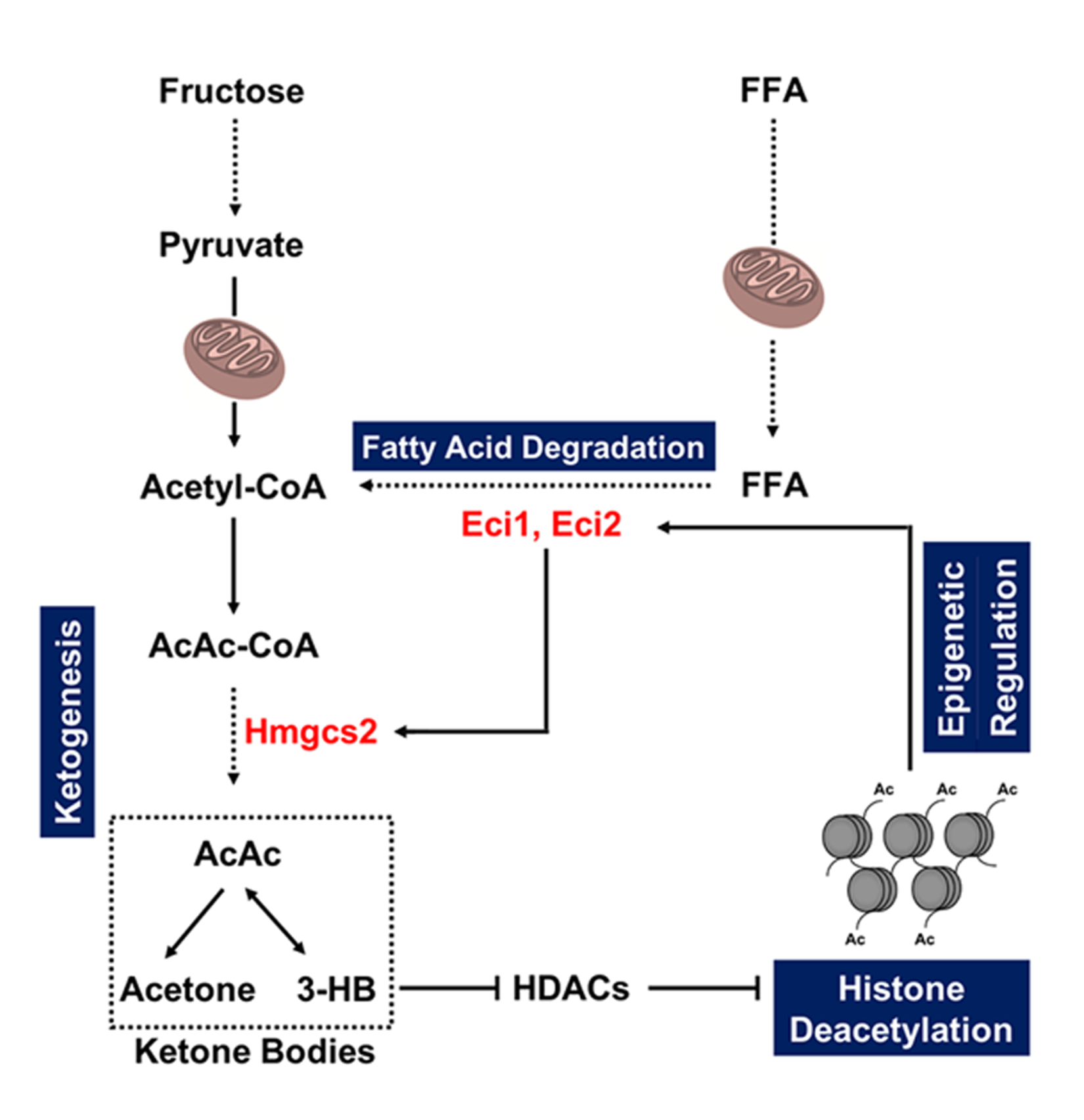
高果糖诱导肾小球足细胞损伤中线粒体功能障碍的模式图
综上所述,该研究初步揭示了果糖驱动的线粒体代谢重编程,而酮体生成和脂肪酸降解代谢模式的重塑能通过扰乱线粒体结构和功能加剧足细胞损伤,为阐明高果糖诱导肾小球足细胞损伤的机制提供了新的见解。抑制酮体生成和脂肪酸降解中的关键酶能有效干预高果糖诱导的足细胞线粒体功能障碍,可为防治相关足细胞损伤提供有希望的治疗靶点。
上述研究工作以"Fructose drives mitochondrial metabolic reprogramming in podocytes via Hmgcs2-stimulated fatty acid degradation"为题于2021年7月9日在线发表(https://www.nature.com/articles/s41392-021-00570-y)于中国科技期刊卓越行动计划领军期刊Signal Transduction and Targeted Therapy。方雷副教授、博士研究生李图帅和章竞子为论文共同第一作者,孔令东教授和方雷副教授为论文共同通讯作者。该研究依托37000cm威尼斯医药生物技术国家重点实验室和37000cm威尼斯化学与生物医药创新研究院,并得到了国家自然科学基金的资助。