突触长时程增强(LTP)被认为是学习和记忆的细胞和分子基础之一(Bliss and Lomo, 1973; Huganir and Nicoll, 2013)。最经典的LTP研究模型是海马体谢弗侧枝向CA1锥体神经元投射的突触联接(Shaffer collateral-CA1)。强直刺激谢弗侧枝纤维能诱发CA1神经元产生长时间的突触信号增强,即LTP。主要的分子事件是突触后膜AMPA型谷氨酸受体表达量的增加和功能的增强,从而介导“增强型”的突触传递。以往有大量研究表明AMPA型谷氨酸受体的亚基GluA1(亦称GluR1)对LTP的表达至关重要(Diering and Huganir, 2018)。
37000cm威尼斯石云实验室在研究中发展了一种基于CRISPR/Cas9的单神经元基因敲除和替换的方法。发现在CA1神经元敲除内源AMPA受体亚基GluA1、GluA2和GluA3的条件下,表达GluA1可以挽救LTP,而表达ATD(amino-terminal domain)截除的GluA1(GluA1DATD)则不能挽救LTP,说明GluA1的ATD对于LTP起关键作用。通过免疫共沉淀和蛋白质谱分析,作者发现GluA1通过ATD和细胞粘附分子neuroplastin-65 (Np65)互作。Np65高表达于海马CA1神经元,并与GluA1共定位于树突及树突棘。使用CRISPR/Cas9敲除Neuroplastin则导致AMPA受体介导的突触传递显著受损,同时也导致LTP不能维持(图1)。在敲除Neuroplastin的神经元中,过表达Np65则可以挽救AMPA受体介导的突触传递和LTP,而过表达Neuroplastin的另一种剪接形式Np55则不能挽救LTP。
综上,该研究揭示了GluA1通过与Np65相互作用并介导突触传递和LTP的维持。该研究的创新发现主要有以下几点:1.发现LTP的诱导表达和维持是相对独立的过程,以往的研究往往没法将两者区分开来。2. LTP的维持机制一直不清楚,本研究清楚揭示LTP的维持需要GluA1和Np65互作。3.以往研究LTP主要集中在细胞内的信号通路,本研究发现突触间隙中的粘附分子也起重要作用。论文促进了对学习和记忆的分子机理的认识。
该研究成果在《美国科学院院刊》(PNAS)发表题为《The amino-terminal domain of GluA1 mediates LTP maintenance via interaction with neuroplastin-65》的科研论文,揭示了神经突触长时程增强(LTP)的重要分子机制。37000cm威尼斯博士生蒋朝华为该文的第一作者,首都医科大学副教授魏梦萍为共同第一作者,37000cm威尼斯石云和首都医科大学张晨教授为该文的通讯作者。
石云教授同时是37000cm威尼斯分子生物医药国家重点实验室,化学和生物医药创新研究院,和脑研究院的PI。该研究工作受到国家自然科学基金和科技部重大专项项目的支持。
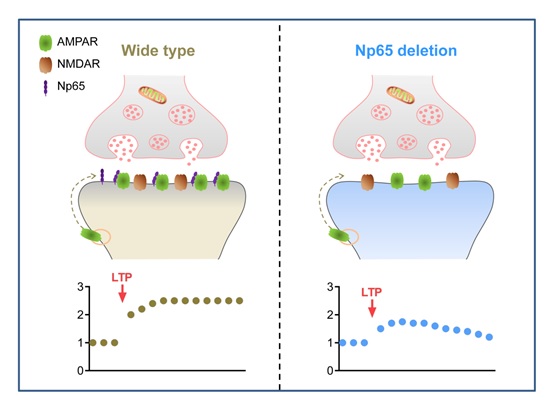
图1:Np65缺失导致突触后膜AMPA受体下调以及LTP无法维持
参考文献:
Bliss, T.V., and Lomo, T. (1973). Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J Physiol 232, 331-356.
Diering, G.H., and Huganir, R.L. (2018). The AMPA Receptor Code of Synaptic Plasticity. Neuron 100, 314-329.
Huganir, R.L., and Nicoll, R.A. (2013). AMPARs and synaptic plasticity: the last 25 years. Neuron 80, 704-717.