肠道微生态在人类健康和疾病中所起的作用引起了国际学术领域的广泛关注,已成为世界科技前沿的热点问题。一些慢性疾病如肥胖、炎性肠病(IBD)、糖尿病、代谢综合征、动脉粥样硬化和肿瘤等都显示与肠道微生态密切相关。在微生态与肿瘤发生领域,已有证据表明肠道微生态不仅能够影响肿瘤的形成和发展,而且可调控肿瘤免疫治疗的效果。然而,国内外目前关于肠道微生物的研究多聚焦于肠道细菌,肠道真菌与肿瘤发生发展的研究鲜有报道。37000cm威尼斯医学院王婷婷课题组的最新研究揭示了肠道中白色念珠菌调控肠道免疫并促进结肠癌发生发展的分子机制。
本项研究首先在真菌的特异性模式识别受体Dectin-3基因敲除鼠(Dectin-3-/-鼠)中构建了炎癌转化的小鼠原位结肠癌模型,发现Dectin-3基因的缺失可导致结肠肿瘤显著增多,且Dectin-3-/-鼠粪便中的真菌负荷较野生鼠明显增高。通过真菌ITS2测序发现其中白色念珠菌(C. albicans)的比例和丰度显著增高。进一步通过粪菌移植实验证实Dectin-3-/-荷瘤鼠的粪便以及白色念珠菌均可以促进CAC的恶性进程,而抗真菌治疗可有效缓解Dectin-3-/-鼠的肿瘤负荷。体内外实验也证实了Dectin-3基因缺失可导致巨噬细胞清除C. albicans的能力受损,使真菌的负荷增多。增多的C. albicans可通过HIF-1途径诱导巨噬细胞的糖酵解水平上升,促使巨噬细胞分泌释放IL-7增多。IL-7的增多有效地促进肠道固有淋巴细胞3(ILC3)中Stat3和AhR转录因子的表达水平上升,继而导致ILC3分泌IL-22的水平上升,促进了肠道上皮细胞的增殖和CAC的进展(图1)。
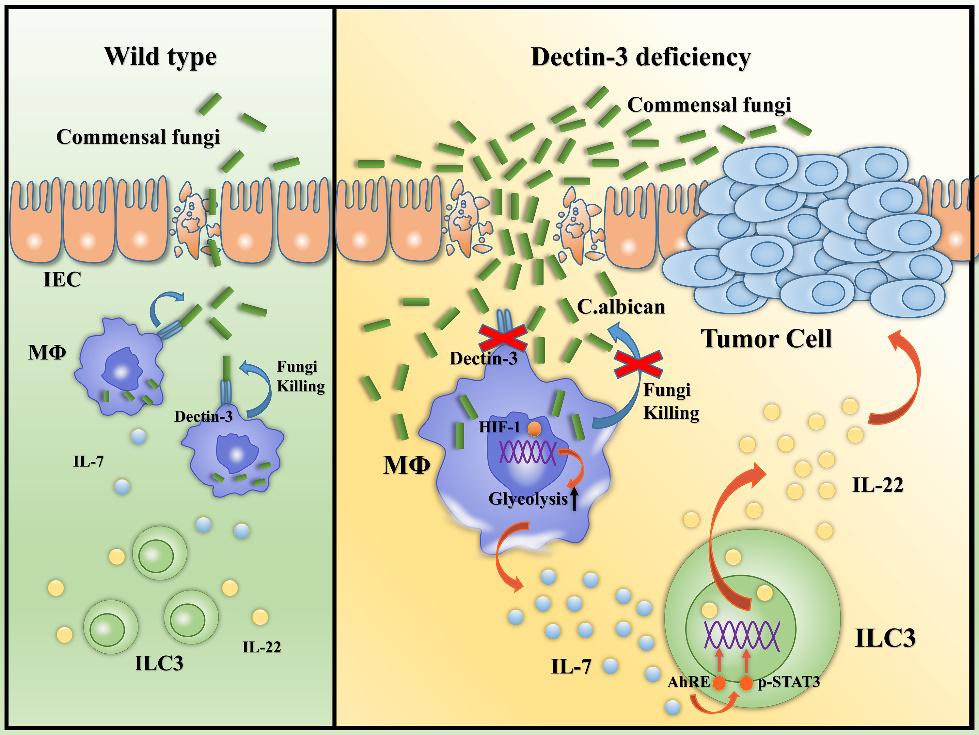
图1:Dectin-3缺乏介导的白色念珠菌增多促进CAC进展
王婷婷教授团队多年来从事肠道免疫及肠道微生态的研究。课题组前期研究发现Dectin-3作为真菌的模式识别受体表达与多种肠道免疫细胞表面,并参与炎症性肠病的发生(Plos Pathogen,2016);并首次证实肠道中热带念珠菌可以促进结肠癌的发生发展(Immunity,2018)(Gut microbe, 2020)。本项研究阐明了Dectin-3缺乏和C. albicans对于肠道免疫以及CAC的影响和作用机制,为肠道真菌与CAC之间的作用关系提供更加新颖深入的认识。
该项研究在EMBO Journal(1区,IF:9.9)以长文形式发表题为Fungal-induced glycolysis in macrophages promotes colon cancer by enhancing innate lymphoid cell secretion of IL-22 的论文。37000cm威尼斯医学院朱雅男和施涛博士为本文的共同第一作者,王婷婷教授为本文的通讯作者。本项研究受到了国家自然科学基金、江苏省自然科学基金、江苏省六大人才高峰、中央高校基本科研业务费等项目的资助。