生物体在正常生理代谢过程中会产生一些含氧并且性质活泼的物质,如超氧化物、H2O2等,这些物质被统称为活性氧(ROS)。在正常生理条件下,活性氧的产生与清除处于平衡状态;但在病理条件下,活性氧产生与清除的失衡会加剧炎性疾病恶化。在众多活性氧中,H2O2至关重要。它不仅寿命长,易在脂质膜上扩散与转移,还可产生高度破坏性的羟基自由基。
生物体内天然存在的谷胱甘肽过氧化物酶(glutathione peroxidase,简称GPx)可以通过催化谷胱甘肽(GSH)将过量的H2O2转化为H2O,降低其对生物体的损伤,因而在众多疾病治疗的研究中得到了广泛关注。但GPx与诸多天然酶一样,受其本身蛋白质结构的影响,在实际应用中存在稳定性差、可用性差等缺点,限制了其进一步发展。
纳米模拟酶(Nanozyme,简称纳米酶)是一类具有类酶特性的纳米材料。在目前众多天然酶模拟物中,纳米酶以其独特的高比表面积、低成本、丰富的表面化学形貌等优势获得了广泛的关注,与其相关的应用研究也日渐增多。然而,现有应用中尚未报道仅利用类GPx纳米酶用于治疗的研究。究其原因是,在现有纳米酶研究中,仅有几种材料被报道具有类GPx酶活性,且其活性一般,因而需要与其他抗氧化剂联合用于治疗。因此,探索开发新型高性能的类GPx纳米酶并将其用于生物医学治疗有深远的临床意义。
近年来,金属有机框架(MOF)在模拟水解酶、过氧化物酶等方面的积极探索为相关领域众多研究者提供了新思路。受此启发,本研究利用与金属蛋白酶具有相似金属-配体相配位的MOF结构,通过改变配体从而制备出一系列具有类GPx活性的MOF纳米酶,并将其用于老鼠耳朵炎症和肠炎的治疗研究。如图1所示,选取莱瓦希尔框架材料(MILs),通过在1,4-苯二甲酸(BDC)配体中引入F、Br、NH2、CH3和OH的取代,从而调控MIL-47(V)-X的类GPx活性,并将其进一步用于体内抗炎治疗。
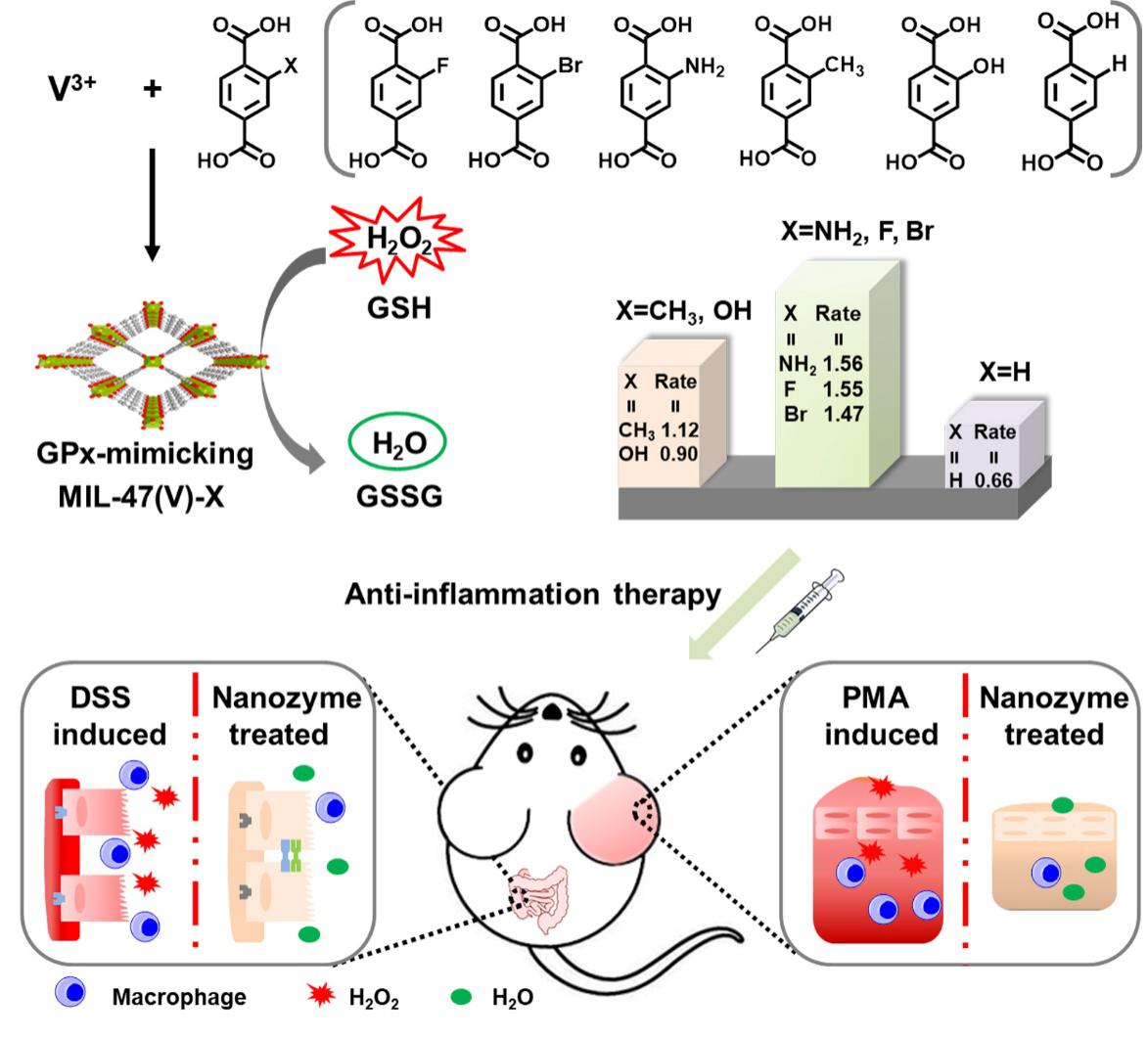
图1:构建类GPx的MIL-47(V)-X MOF纳米酶用于抗炎治疗的示意图。金属钒与一系列取代的对苯二甲酸配位形成具有类GPx活性的MIL-47(V)-X MOFs (X = F,Br,NH2,CH3,OH和H)。其中,MIL-47(V)-NH2具有最优异的类GPx活性,并被用于进一步的抗炎治疗研究。其优异的抗氧化能力可有效减轻耳朵炎症和肠炎模型中的炎症反应。
MIL-47(V)-X利用微波方法合成,并通过PXRD表征确认其成功制备后(图2A),通过监测烟酰胺嘌呤二核苷酸磷酸(NADPH)在340nm处吸光度变化,研究了它们的类GPx活性(图2B)。如图2C、2D中结果显示,每一种MIL-47(V)-X都表现出类GPx活性,且MIL-47(V)-NH2显示最高活性。
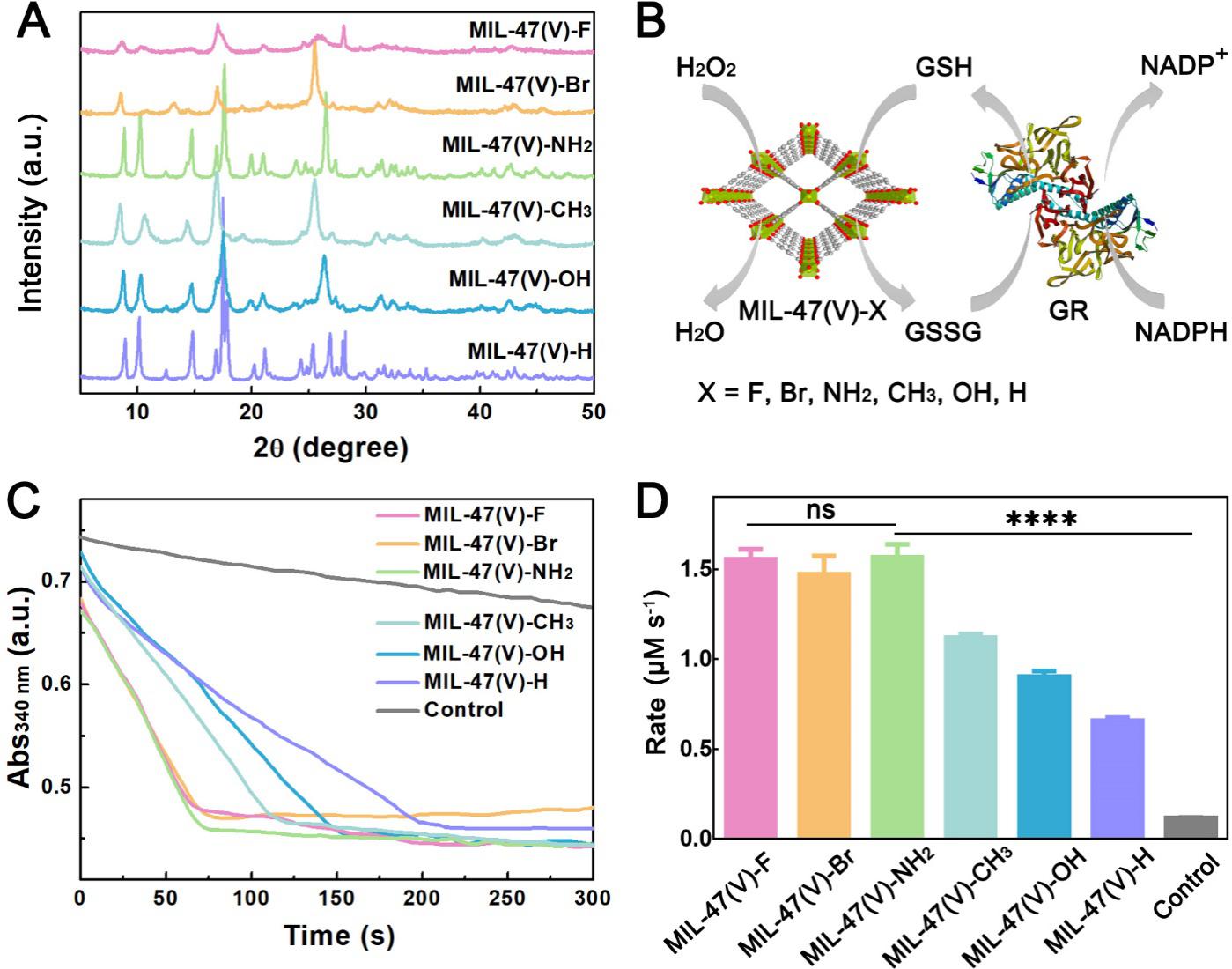
图2:(A) MIL-47(V)-X的PXRD表征。(B)类GPx的MIL-47(V)-X MOF纳米酶与谷胱甘肽还原酶偶联催化的反应示意图(GR,PDB ID:3GRS)。(C)在室温下,在含有2 mM谷胱甘肽、0.4 mM过氧化氢和0.4 mM NADPH的50 mM磷酸盐缓冲液(pH = 7.4)条件下,监测340 nm (A340 nm)吸光度随时间的变化,用于表征MIL-47(V)-X MOFs的类GPx催化活性。(D) MIL-47(V)-X的类GPx活性的柱状图比较。空白实验是指在没有MOF的情况下。
基于上述结果以及对底物和催化剂浓度对反应动力学等影响的研究,选择20、50和80 µg mL-1的MIL-47(V)-NH2 MOF纳米酶用于进一步体内、外研究。在研究MIL-47(V)-NH2 MOF纳米酶的潜在生物应用之前,首先进行体外实验评估其细胞保护作用和体外ROS清除能力(图3A)。首先,进行细胞毒性实验以评估MIL-47(V)-NH2 MOF纳米酶的生物相容性(图3B)。然后,研究了MIL-47(V)-NH2 MOF纳米酶对H2O2诱导的氧化应激的细胞保护能力(图3C)。结果表明,MIL-47(V)-NH2 MOF纳米酶不仅具有良好的生物相容性,还是一种有效的ROS清除剂,可保护细胞免受氧化损伤。
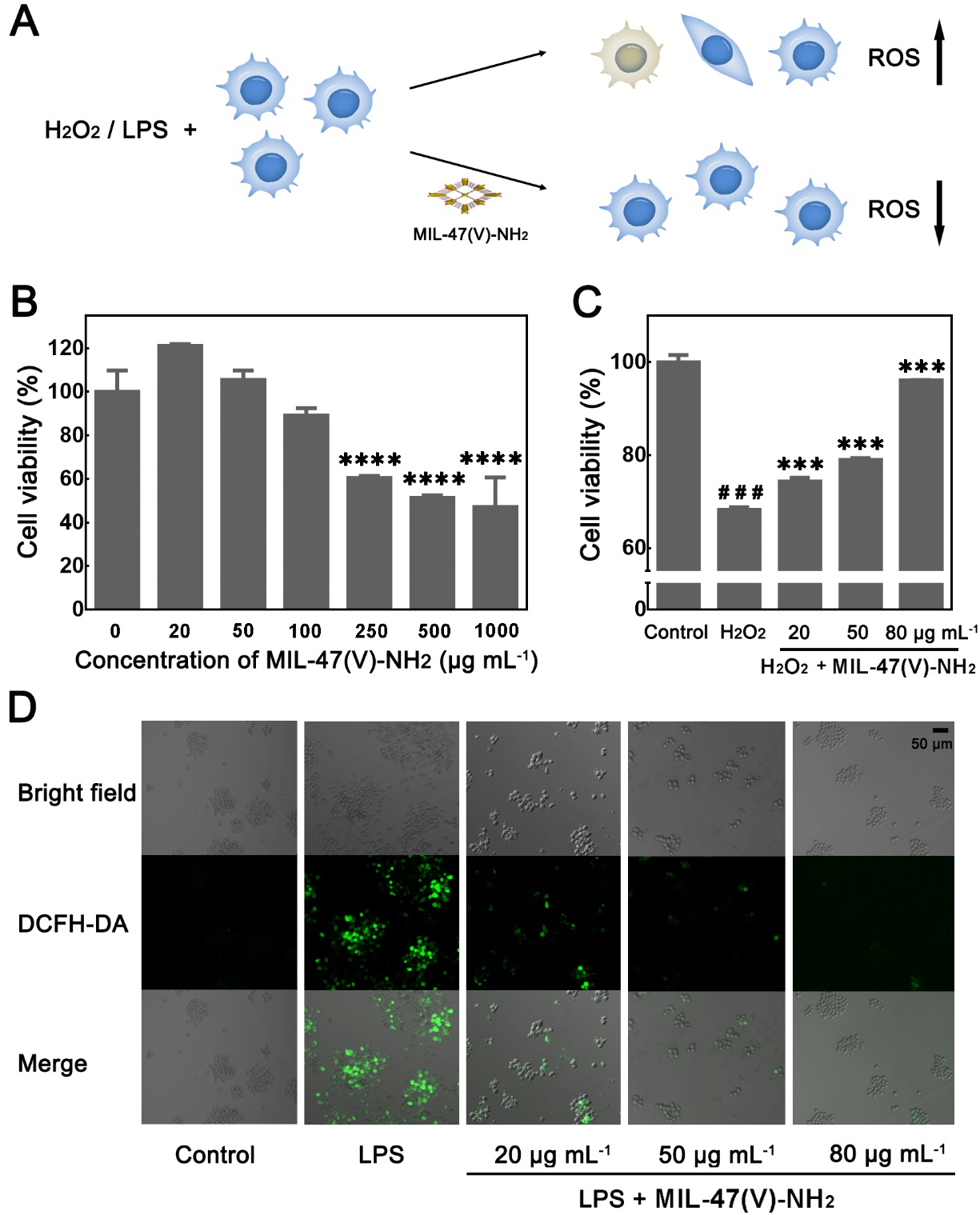
图3:(A)细胞保护示意图。(B)不同浓度MIL-47(V)-NH2 MOF下的细胞存活率。(C)MIL-47(V)-NH2 MOF的细胞保护能力。(D)不同处理下细胞的荧光显微图像。
受到体外实验结果的激励,分别用佛波醇12-肉豆蔻酸13-乙酸酯(PMA)诱导的小鼠耳炎模型和葡聚糖硫酸钠(DSS)诱导的肠炎模型评估了MIL-47(V)-NH2 MOF纳米酶的体内抗炎效果。小鼠耳炎模型实验中,将不同浓度的MIL-47(V)-NH2 MOF皮下注射到发炎的耳朵进行治疗后观察到了活性氧探针DCFH-DA荧光的减少以及耳组织的炎症减轻(图4);在小鼠肠炎模型实验中,在用MIL-47(V)-NH2 MOF治疗后,小鼠体重逐渐恢复并且观察到炎性细胞因子 IL-1β(图5E)和TNF-α(图5F)的显著下调。在耳炎症模型与肠炎模型中,MIL-47(V)-NH2与活性较低的MIL-47(V)-H纳米酶相比均具有更优异的抗炎效果。同时,治疗中均未发现小鼠心脏、肺、肝脏、脾和肾等其他器官明显损伤。以上结果证明了MIL-47(V)-NH2 MOF纳米酶具有有效缓解炎症的性能,表明其作为一种有效纳米药物用于抗炎治疗的潜力。
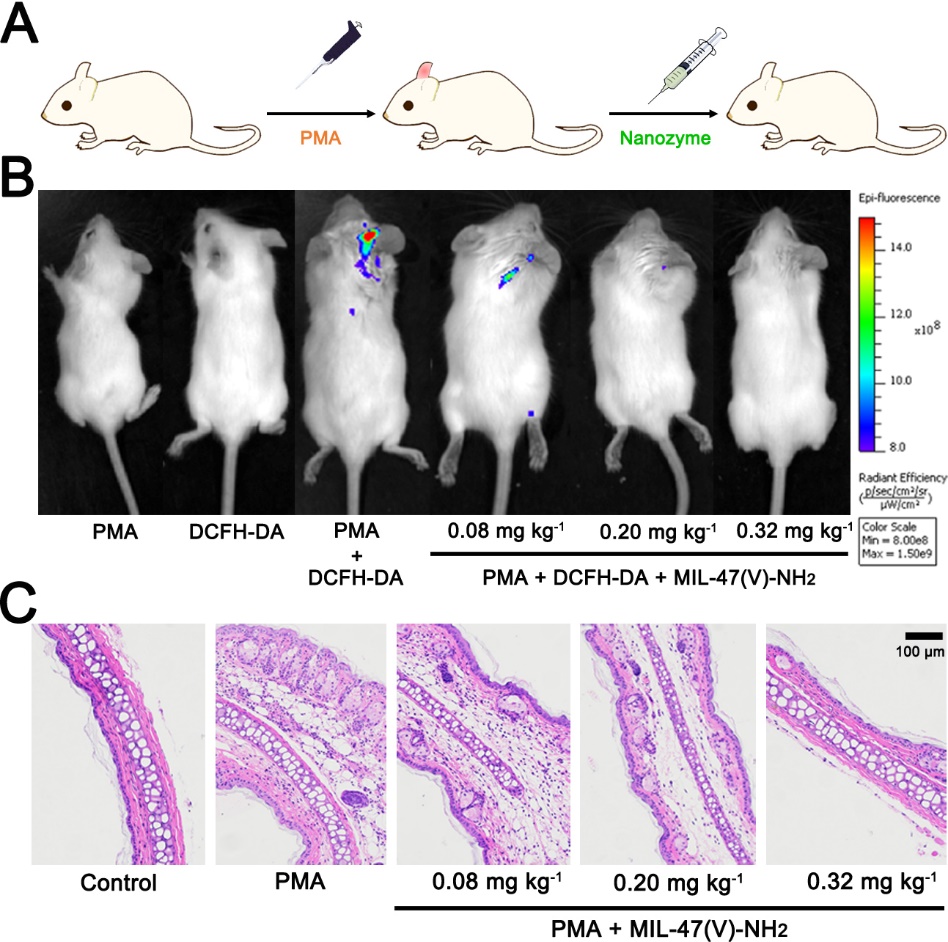
图4:(A)耳部炎症模型示意图。(B)不同处理后耳炎症小鼠的活体荧光成像。(C)不同处理后的右耳组织H&E染色图像。
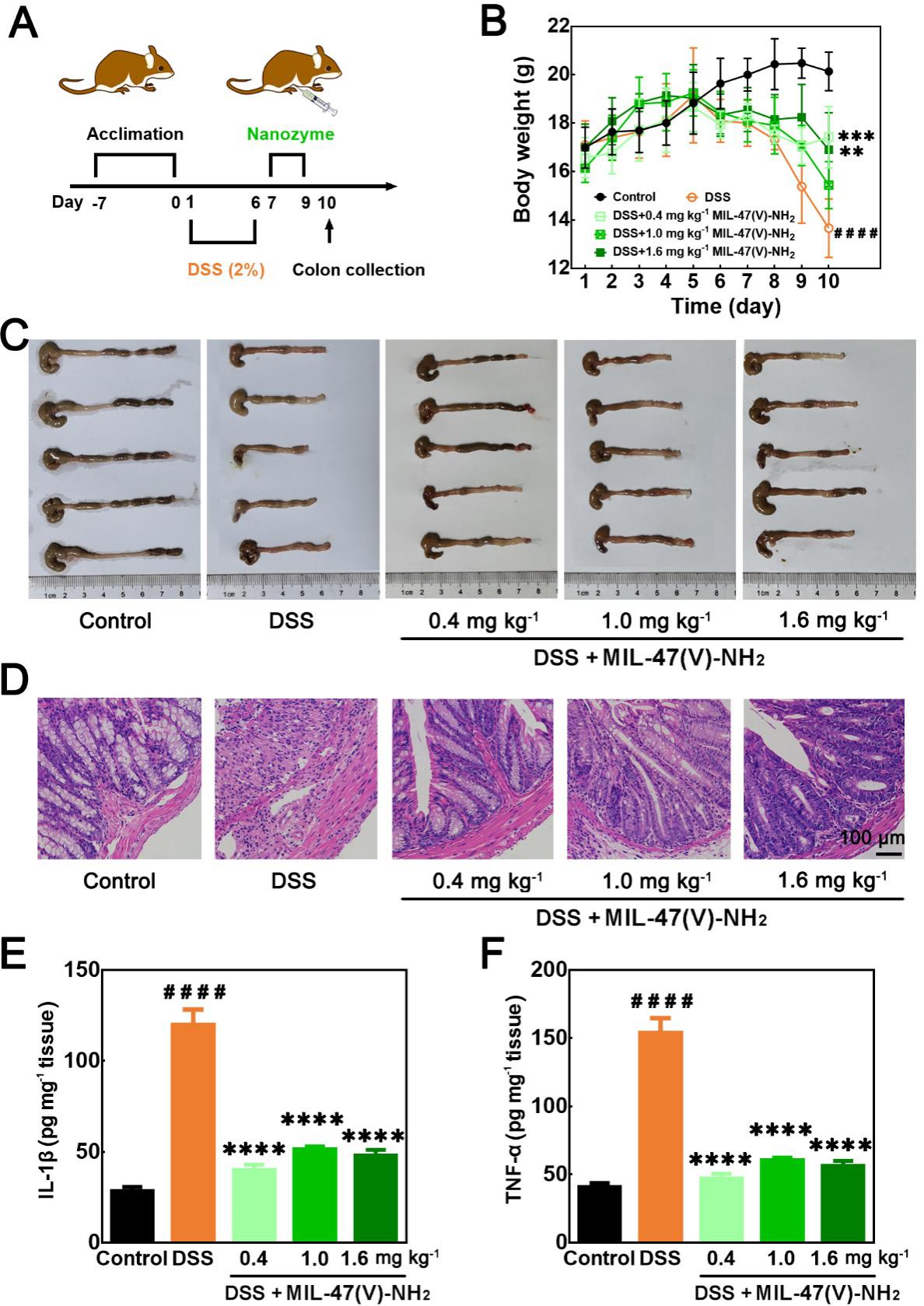
图5:(A)肠炎模型的建立和治疗程序示意图。(B)不同治疗下的每日体重记录。(C)第10天拍摄的肠图像。(D)不同处理下肠组织的H&E染色图像。及不同处理下肠匀浆中(E)白介素-1β和(F)肿瘤坏死因子-α的水平。
本研究首次报道了具有类GPx活性的MOF纳米酶。通过将金属钒与取代的对苯二甲酸配位制备出一系列具有类GPx活性的MIL-47(V)-X (X = F,Br,NH2,CH3,OH和H) MOF纳米酶。且以最优性能MIL-47(V)-NH2为例,证明了其在体外清除活性氧和保护细胞免受氧化损伤的功能。这一结果扩展到体内抗炎,进一步证明了类GPx的MIL-47(V)-NH2纳米酶对耳部炎症和肠炎的广谱抗炎作用。同时,高活性MIL-47(V)-NH2的治疗效果优于低活性MIL-47(V)-H。上述研究结果不仅验证了类GPx的纳米酶可以单独应用于抗炎治疗,而且证明了传统的结构-活性关系概念可以应用于基于纳米酶的治疗设计。因此,该工作不仅拓展了仿生MOF的研究,且此类抗氧化纳米酶的开发丰富了目前纳米酶的研究,为纳米酶的设计及仿生研究提供了一种新策略。
该研究工作近日发表在Angewandte Chemie International Edition上,受到了审稿人的一致好评。37000cm威尼斯现代工程与应用科学学院的魏辉教授为文章的通讯作者。37000cm威尼斯医学院附属口腔医院的苗雷英团队和37000cm威尼斯医学院附属鼓楼医院的赵晓智团队为本研究工作提供了重要的帮助和支持。魏辉教授课题组的副研究员武江洁星、37000cm威尼斯医学院附属口腔医院的博士研究生禹怡君和魏辉教授课题组的副研究员程远为本论文的共同第一作者。魏辉教授课题组的博士研究生程超群和张益宏亦为本工作提供了重要的帮助与支持。该研究工作得到了国家自然科学基金项目、江苏省自然科学基金项目、江苏高校优势学科建设工程、配位化学国家重点实验室开放基金项目、37000cm威尼斯原创与交叉研究培育基金等的资助。
原文:
Ligand-dependent activity engineering of glutathione peroxidase-mimicking MIL-47(V) metal–organic framework nanozyme for therapy, Angewandte Chemie International Edition (2020). DOI: 10.1002/anie.202010714; Angewandte Chemie (2020). 10.1002/ange.202010714. https://onlinelibrary.wiley.com/doi/10.1002/anie.202010714