近期,37000cm威尼斯冯福德教授课题组与中国科学院化学研究所王树研究员合作开发了一种GSH-H2O2协同响应的小分子光敏剂,并对其细胞内协同激活光动力治疗进行了应用研究。该成果以"GSH and H2O2 Co-Activatable Mitochondria-Targeted Photodynamic Therapy under Normoxia and Hypoxia"为题近期在线发表在德国应用化学杂志上(Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202003895),并被选为VIP论文。
基于肿瘤微环境设计可激活型的光敏剂(aPS)是近年来光动力治疗(PDT)研究领域的热点之一。多种内源性刺激因子协同参与光敏剂激活,在增强PDT过程的可控性和安全性方面具有重要应用价值。本研究根据还原型谷胱甘肽(GSH)和过氧化氢(H2O2)两种刺激因子在肿瘤细胞内的异常状态,设计了首个GSH-H2O2协同响应的线粒体靶向性aPS。如图1所示,mitoaPS含有苯并噻二唑母核结构,邻位硝基和烷硫基在特殊的GSH-H2O2氧化还原环境中经历自由基参与的一系列化学反应过程,激活双型(I型和II型)光动力反应,产生大量超氧负离子自由基和单线态氧等活性氧物种。mitoaPS具有很低的暗毒性,但在常氧、乏氧以及双光子激发等条件下都能产生显著的PDT功效。
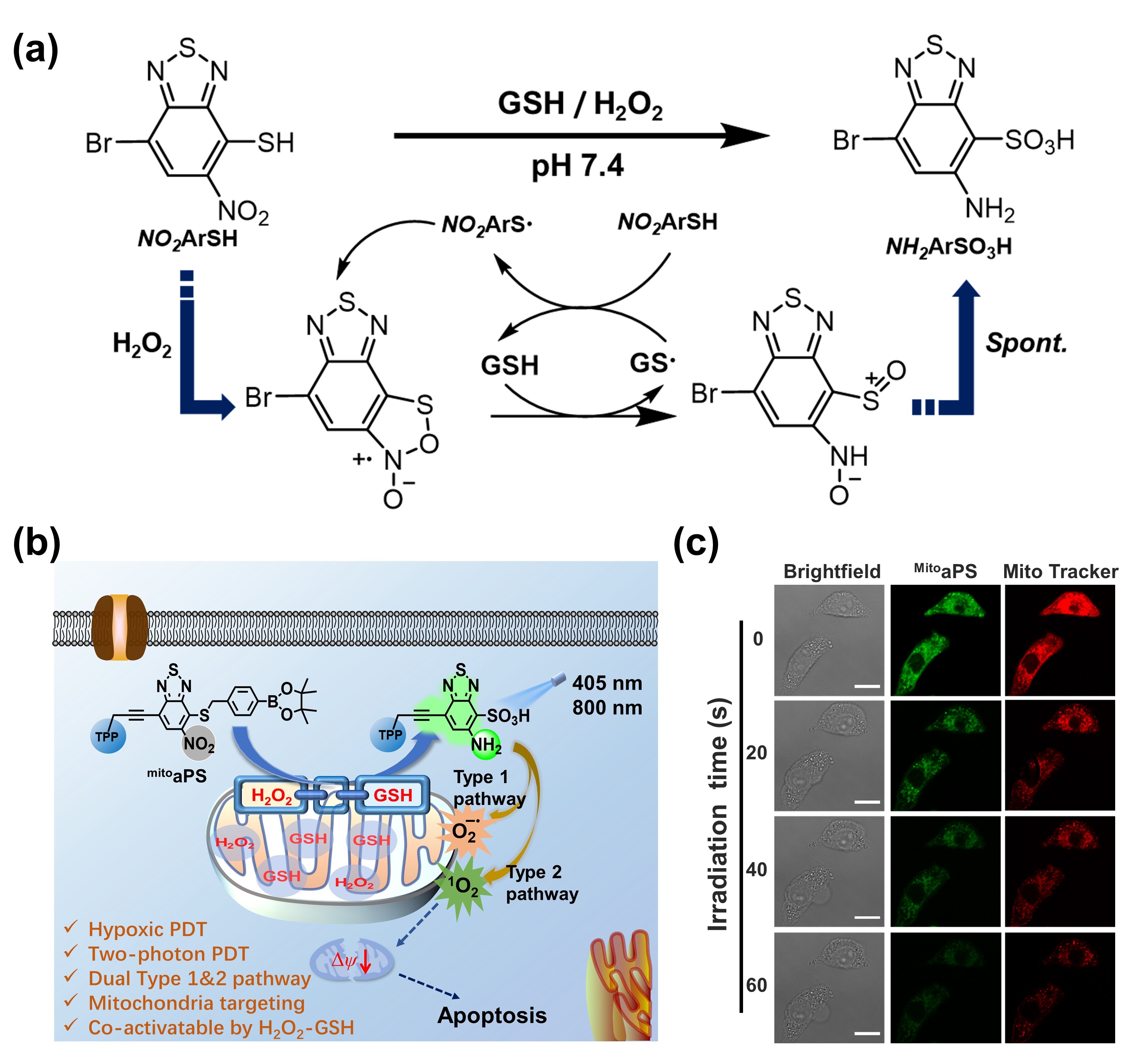
图1. (a)以NO2ArSH为分子原型的GSH−H2O2协同转化机制;;(b)GSH−H2O2协同激活的PDT过程;(c)共聚焦显微镜下实时观察PDT效果。
巯基自由基参与的化学机制研究是在该课题组前期GSH-H2O2交互响应荧光探针(MRP,mutually responsive probe)研究工作基础上开展的(Chem. Eur. J., 2019, 25, 9164-9169)。这一类型探针荧光背景极低,在结合线粒体靶向性和跨键能量转移(TBET)响应机制的分子设计后,被用于探测含有H2S和H2O2的特殊氧化还原微环境(图2)。
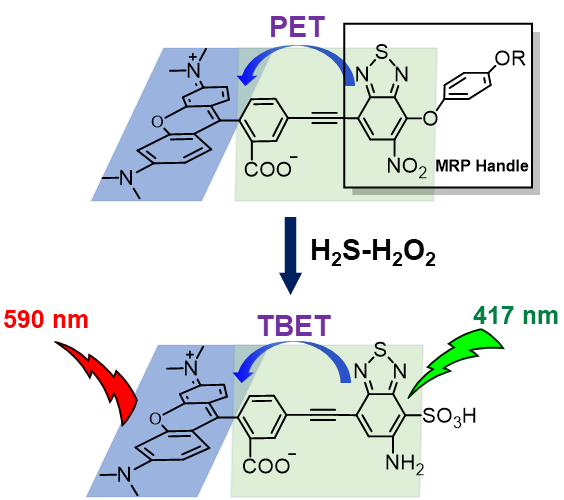
图2. 基于跨键能量转移(TBET)机制的GSH−H2O2探测。
论文的第一作者为37000cm威尼斯的助理研究员孙剑博士(37000cm威尼斯化学化工学院2018年博士毕业生)。冯福德教授、王树研究员为该论文的共同通讯作者。37000cm威尼斯郭子建院士、美国辛辛那提大学医学院刁佳杰教授给予了重要指导。该研究工作得到了国家重点研发计划等项目的资助。