2020年2月5日,国际著名学术期刊《Nature Communications》在线发表37000cm威尼斯医学院赵越、方雷、李朝军团队的原创研究“Liver governs adipose remodelling via extracellular vesicles in response to lipid overload”,揭示了在营养过剩状态下,肝脏感知机体营养状态,重塑脂肪组织功能,调节机体脂质分布的新机制。
生物体整体的代谢稳态依赖于细胞、组织、器官之间通讯交流,特别是肝脏、脂肪、骨骼肌等代谢器官相互协同,调节机体对糖脂蛋白质等营养物的利用和储存,以适应外界营养物的供给变化。但是除了神经内分泌的调控作用外,哪一个代谢器官起到先导的中心调节作用还不清楚。该团队的研究发现,肝脏最先感知机体的营养状态,并通过分泌肝源调节因子发出指令,特异性调控脂肪组织中脂肪细胞的分化和脂质的积累,协调脂质在机体不同器官的储存和积累。
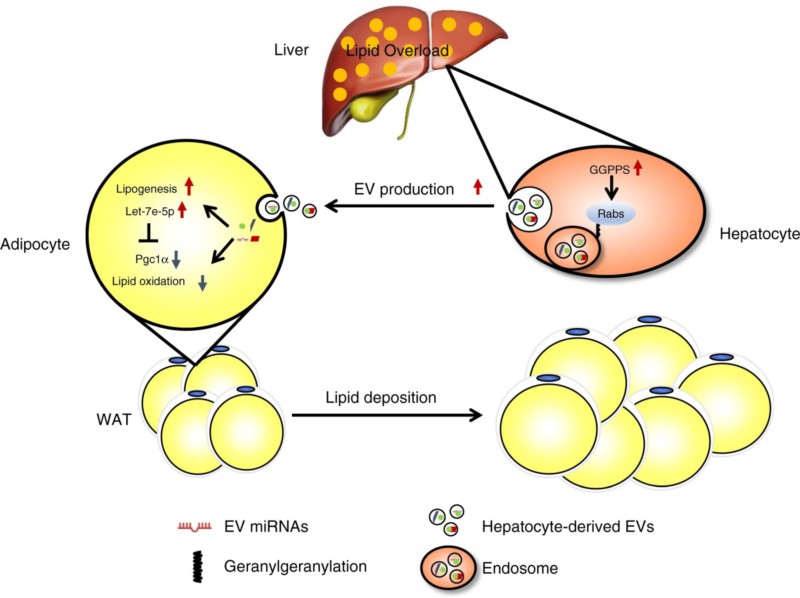
营养物在肠道消化后,乳糜微粒等通过肝窦迅速进入肝脏为肝细胞吸收。但肝脏如何感知营养物状态,进而分泌具有细胞特异性信号的肝源因子,靶向调节特定的组织器官,以维持机体代谢平衡的机制目前还不清楚。
该研究发现,高脂食物处理的营养过剩状态下,小鼠肝细胞内的胆固醇合成代谢途径中的香叶基香叶基合成酶GGPPS迅速产生应答,通过影响Rab蛋白的异戊二烯化,调节细胞外囊泡(extracellular vesicles,EV)的形成和分泌。EV会携带一些信号分子(mRNA、miRNA和蛋白质)靶向作用到较远的组织或细胞中,调节靶细胞的生物学功能。该团队从肝细胞分泌的EV中鉴定出调控脂肪组织功能的miRNA,并明确其通过靶向脂肪细胞脂代谢相关基因如PGC1a,调控脂肪组织的脂质积累。
该项研究表明,在一定的脂代谢压力下,肝脏不仅仅是一个被动的脂质异位沉积器官,反而能够率先响应不同代谢压力信号,通过产生相应的EV远程调控脂肪组织的功能,协调不同器官的脂质分布,维持机体稳态。研究扩大了对肝脏作为代谢节点的认知,为防治肝脏代谢紊乱所致的代谢异常提供新的诊断依据及药物靶点。
该研究中,37000cm威尼斯医学院助理研究员赵越为本文的第一作者,37000cm威尼斯李朝军教授、方雷副教授和37000cm威尼斯附属鼓楼医院孙喜太主任为该论文的共同通讯作者,共同作者还有南京医科大学附属逸夫医院薛斌教授。该研究受到了国家自然科学基金面上项目、国家自然科学基金青年项目、中国博士后基金、江苏省自然科学基金社会发展面上项目、江苏省自然科学基金青年项目及中央高校基本业务经费项目等的资助。
(文章链接:https://www.nature.com/articles/s41467-020-14450-6)