碳氢键是有机分子中最基本、最普遍的化学键。如何对惰性的碳氢键进行高效地转化,是有机化学的前沿热门领域。由于复杂的有机分子中通常含有多个不同类型的碳氢键,如何精准地活化某一个特定位置是该领域的难点。目前最有效的策略是利用导向基团与金属配位来实现。从早期利用锂试剂进行邻位锂化,到现在广泛使用的过渡金属参与的导向金属化,金属与碳氢活化一直是紧密相连的。然而,这些方法通常使用贵金属作为催化剂,造成生产成本上升、产物中重金属残留等问题,这些在药物合成中尤为突出。因此,开发无金属参与的导向碳氢活化反应显得十分重要。
37000cm威尼斯化学化工学院史壮志教授课题组在非传统反应位点精准官能团化领域已经取得一系列成果(图1)。1)利用过渡金属催化实现吲哚4-7号位精准的碳氢芳基化、烷基化、烯基化、酰基化,打破吲哚官能团化优先发生在2,3号位的规律;2)发展了一系列非传统反应位点的精准硼化反应。硼酸酯类化合物在材料、药物以及化工合成中均有广泛的应用。基于硼化学的多样性,实现了对碳氢、碳氟、碳氮和碳碳键等进行精准切断、硼化,得到高值的有机硼产物,为碳硼键的构建提供了新的思路。
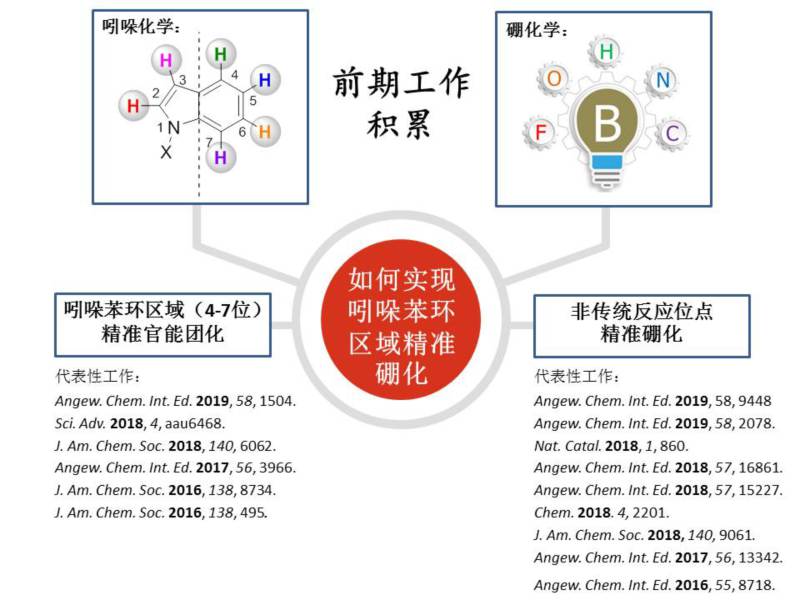
图1. 课题组研究基础
在吲哚苯环区域实现精准的碳氢硼化是一个非常重要,且极具挑战的研究课题。近期,该团队发现了一类无金属参与的精准碳氢硼化方式。硼作为一种非金属原子,有部分金属特性。利用硼原子的金属特性与导向基团配位,可以在无需金属参与的情况下实现碳氢活化、硼化反应。其开发的方法是利用非常廉价、易得的三溴化硼作为硼源,与酰基配位发生碳氢活化,再经过后续处理,高产率、高效率的得到各类硼酸酯。在吲哚氮原子上安装叔丁酰基,可在吲哚的7号位发生精准的硼化反应;在吲哚的3号位安装叔丁酰基,就能在吲哚的4号位发生碳氢硼化反应。更重要的是,该无金属策略适用于其它芳杂环邻位的碳氢键硼化,具有非常高的普适性。在美国加利福尼亚大学洛杉矶分校(UCLA)K. N. Houk教授协助下,结合理论计算和实验辅助,首次发现了三溴化硼的双重角色:既作为反应原料又是催化剂。该发现不仅为碳硼键的构建、天然产物及药物分子的合成提供了新的手段,而且简化了反应用料,降低了反应成本,避免了在药物合成中重金属残留等问题,具有重要的合成化学价值和良好的工业应用前景(图2)。
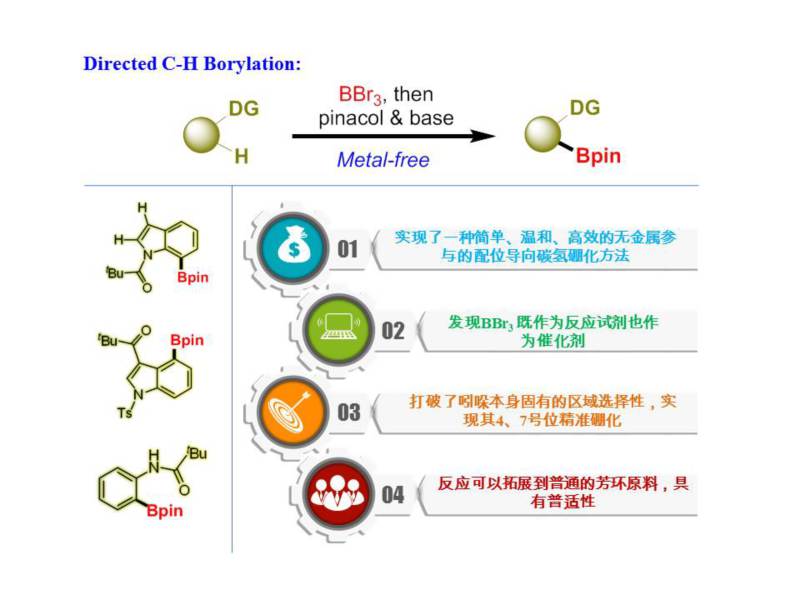
图2. 无金属导向碳氢硼化
该成果“Metal-free directed C-H bond activation and borylation”以我院为第一通讯单位发表在Nature上(论文链接:https://www.nature.com/articles/s41586-019-1640-2)。博士研究生吕佳航(37000cm威尼斯、扬州大学联合培养)为第一作者。文章的计算部分是与美国加州大学洛杉矶分校K.N.Houk教授合作完成。该项目得到了国家自然科学基金、江苏杰出青年基金、江苏省“双创计划”的大力支持。
(化学化工学院 科学技术处)