肥胖促进了2型糖尿病的流行,其中脂肪组织免疫紊乱导致的炎症、纤维化和胰岛素抵抗是促发2型糖尿病的关键诱因,但其区域免疫特性以及与疾病内在联系尚未阐明。固有免疫细胞(ILCs)是一类新型免疫细胞群体,包括ILC1,ILC2和ILC3,在黏膜组织和多器官广泛分布,以ILCs为核心的免疫调控网络在代谢性疾病中的作用初现端倪,但其在人类2型糖尿病中的作用及具体机制仍不清楚。
鉴于此,37000cm威尼斯医学院附属鼓楼医院内分泌科朱大龙教授、毕艳教授团队和普外科孙喜太教授团队、上海市免疫学研究所沈蕾教授团队整合了多学科研究体系,构建免疫细胞表型分析和功能研究平台,并建立多种免疫缺陷动物模型,探究了脂肪组织区域免疫特性与2型糖尿病的内在联系。
研究纳入了肥胖患者以及非肥胖非糖尿病健康对照,所有受试者均采集网膜脂肪组织和外周血标本,肥胖患者术后3个月随访时再次采集外周血标本。研究首次发现,较正常对照者相比,肥胖患者脂肪组织和外周血ILC1s水平显著升高,且在肥胖2型糖尿病患者中进一步升高;肥胖2型糖尿病患者术后的外周血ILC1s水平显著降低,且ILC1s减低幅度与糖代谢改善程度显著相关;同时,脂肪组织ILC1s水平与组织纤维化程度呈显著正相关。
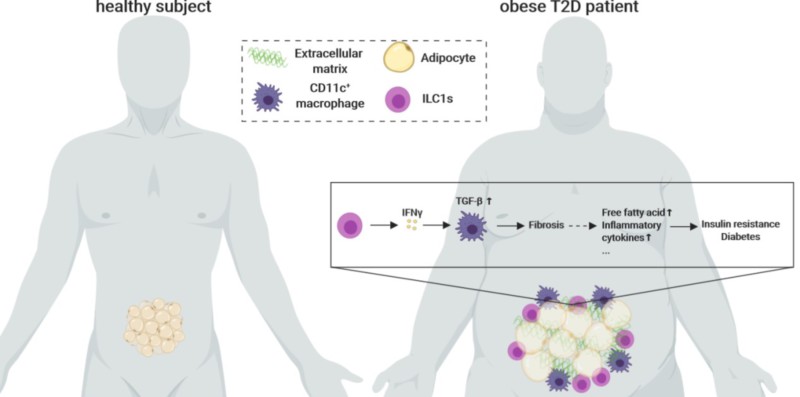
深入机制研究发现,脂肪组织ILC1s通过分泌IFN-γ活化CD11c+巨噬细胞,诱导脂肪组织纤维化发生;在重度免疫缺陷小鼠的脂肪组织中重建ILC1s后,脂肪组织纤维化和糖代谢损伤程度显著加重,而重建无功能ILC1s(IFN-γ基因敲除)的小鼠并未出现上述病理改变。随后的干预实验发现,应用IL-12中和抗体阻断脂肪组织ILC1s异常积聚后,2型糖尿病小鼠脂肪组织纤维化和糖代谢损伤显著改善。研究首次发现脂肪组织ILC1s促进了2型糖尿病的发病,ILC1s作为肥胖进展为2型糖尿病的重要驱动因子,可能成为肥胖2型糖尿病防治的新靶点。
该研究以“Adipose group 1 innate lymphoid cells promote adipose tissue fibrosis and diabetes in obesity”(脂肪组织Ⅰ类固有免疫细胞促进肥胖相关脂肪组织纤维化和糖尿病发生)为题,于2019年7月22日在Nature Communications(《自然通讯》)上在线发表。37000cm威尼斯医学院附属鼓楼医院内分泌科王洪东博士、上海市免疫学研究所沈蕾教授、37000cm威尼斯医学院附属鼓楼医院普外科孙喜太教授、内分泌科刘芳岑博士和朱大龙教授为该论文的共同第一作者,毕艳教授为通讯作者。
该研究得到国家自然科学基金面上项目(批准号:81770819)的资助。
论文链接:https://doi.org/10.1038/s41467-019-11270-1
(医学院 科学技术处)