近日,37000cm威尼斯医学院曹望森教授课题组和蒋青教授课题组联手在骨关节炎表观遗传病理机制研究中取得重要进展,部分结果以“PPARg preservation via promoter demethylation alleviates osteoarthritis in mice” 为题于6月25日在线发表在国际风湿病及骨关节炎学科原创研究排名第一杂志《风湿病年鉴》 (Annals of the Rheumatic Diseases)。
骨关节炎为多种病因如肥胖、性别差异,关节劳损、创伤、先天性遗传缺陷等引起的骨关节软骨和关节下骨退行性病变,是中老年人最常见的骨关节疾病,60岁后男女患病率分别高达10%及18%,临床表现为缓慢发展的关节疼痛、僵硬、肿胀、活动受限和关节畸形,缺乏有效药物治疗,严重患者需行关节置换手术。在细胞水平,骨关节炎的发生发展与氧化应激失衡,过度炎症反应,以及软骨细胞合成,分解代谢相关蛋白表达异常密切相关。尽管许多患者具有类似的病理诱因,但罹患骨关节炎的易感性,病情严重程度及对治疗的反应不一,影响病情,疗效和预后的判断。近来众多研究表明表观遗传DNA甲基化异常能够导致骨关节炎相关蛋白表达紊乱,部分解释了骨关节炎发病和病程的个体差异,但这些病理改变是骨关节炎的诱因或是结果,以及哪些表观遗传敏感基因控制骨关节炎的发生发展依旧不明。
基因转录子PPARg ( 氧化物酶体增殖物激活受体伽玛 ,Peroxisome proliferator-activated receptor gamma )是核激素受体家族成员,广泛分布于各种组织细胞,主要参与调控脂肪组织分化和代谢,同时也是重要的骨关节保护蛋白。PPARg启动子含有经典的CpG岛,是表观遗传DNA甲基化修饰的敏感位点,但PPARg是否在骨关节炎发生发展中受表观遗传DNA甲基化异常调控及功能相关性尚无报道。课题组对骨关节炎患者和小鼠膝关节内侧半月板失稳术DMM (destabilization of medial meniscus)造模的骨关节炎关节软骨检测发现PPARg蛋白水平明显下降,与野生型小鼠相比,PPARg基因敲除小鼠的骨关节炎损伤更加严重。进一步检测PPARg下降的上下游病理过程/信号通路发现骨关节炎关节软骨中PPARg启动子呈现DNA超甲基化。DNA甲基转移酶(DNA methyltransferase) DNMT1和DNMT3a特异性表达上升。接着,体外培养的软骨细胞和小鼠骨关节研究证实DNMT1/3a抑制剂5-氮杂-2'-脱氧胞嘧啶核苷(5Aza, 5-Aza-2'-deoxycytidine) 能够有效去除IL-1b及DMM诱导的PPARg启动子超甲基化,缓解PPARg下调及相关的氧化应激失衡和过度的炎症反应, 改善骨关节炎相关蛋白的表达和骨关节损伤。 进一步对野生小鼠和PPARg基因敲除小鼠的比较研究表明药理性抑制DNMT1/3a能够显著的缓解野生型小鼠的骨关节炎病理改变,但对PPARg基因敲除小鼠的保护作用不明显,说明PPARg是骨关节炎表观遗传DNA甲基化紊乱病理机制中的关键效应蛋白,其上游DNMT1/3a的异常升高能够导致PPARg启动子超甲基化及PPARg表达下降,降低了PPARg拮抗骨关节氧化应激失衡和过度炎症反应能力,最终诱导并加重骨关节炎的发生发展 (见插图)。
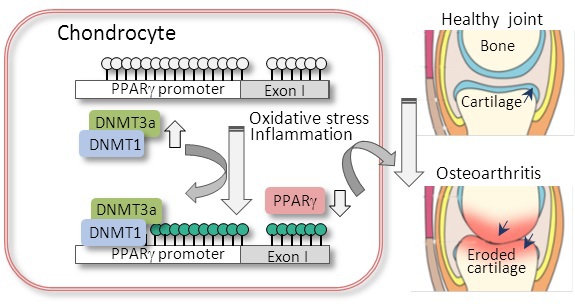
这些研究结果表明DNMT1/3a/PPARg轴在表观遗传失常和关节炎发生发展中起重要作用,揭示了骨关节炎表观遗传DNA甲基化异常的关键调控通路和基因靶点,提示由于家庭遗传或环境因素,过去疾病或服药史导致该通路相关基因表达失常有可能增加罹患骨关节炎的风险或加重骨关节炎病程。该研究还为进一步研发靶向DNMT/PPARg通路的有效制剂治疗骨关节炎和相关疾病提供新的契机。
该论文第一作者为朱晓波硕士,博士研究生陈芳,陆克和韦嗳提供了转基因小鼠等技术支持,曹望森教授和蒋青教授为共同通讯作者。研究受到国家自然基金委重点项目(81730067),面上项目 (81470940, 81670762) 和国际合作项目 (81420108021) 资助。
(医学院 科学技术处)