2019年5月23日,37000cm威尼斯模式动物研究所甘振继课题组在国际著名学术期刊《PNAS》上长文发表题为“Coupling of COPII vesicle trafficking to nutrient availability by the IRE1-XBP1s axis”的研究成果(https://www.pnas.org/content/early/2019/05/22/1814480116),揭示了肝脏蛋白与脂质运输的营养感受调节新机制。37000cm威尼斯为本文第一单位,37000cm威尼斯甘振继教授和北京大学陈晓伟教授为该篇论文共同通讯作者,共同作者里还有武汉大学刘勇教授等。
研究细胞对营养状态的感知与应答机制,对认识机体代谢平衡的调节具有重要意义。肝脏细胞代谢具有高度的可塑性,肝脏可通过调节脂质与蛋白质的分泌来适应生理营养状态变化的波动。例如,在肝脏胆固醇和脂肪酸吸收/合成过量或者外周脂质需求增加的情况下,大量的脂质便会以富含载脂蛋白B(ApoB)的极低密度的脂蛋白(VLDLs)的形式从肝脏转运到血液中。大量研究表明,肝脏脂质分泌异常与脂肪肝等代谢疾病的发生发展密切相关。作为一种进化上十分保守的细胞内运输机器,COPII膜泡对于肝脏蛋白质和脂类等物质的运输至关重要。在哺乳动物中,约三分之一的编码蛋白在细胞内的转运由COPII负责完成。以往关于COPII膜泡是如何精细组装的研究已十分充分。然而,对于COPII介导的分泌是如何动态调控以适应细胞营养状态变化引起的分泌需要改变却十分不清楚。
内质网是COPII分泌的起点,同时内质网也被视为一个重要的细胞营养代谢感受传感器,可协调营养刺激与细胞葡萄糖、脂质和蛋白质代谢。为了解析内质网营养感受通路与COPII介导的分泌之间的机制关联,甘振继、刘勇与陈晓伟指导的研究生刘林、蔡杰、王惠敏、梁喜俊和周倩等开展合作研究,在体外细胞和小鼠肝脏上的研究发现,细胞营养状态引起的COPII分泌功能改变与细胞的XBP1s转录因子活性高度正相关。通过对小鼠肝脏XBP1s在喂食/禁食两种状态下的染色体结合动态变化研究发现,XBP1s能在喂食情况下直接结合到COPII膜泡分泌相关基因的启动子上,而在禁食的肝脏中却显著降低。利用体外活细胞实时观测和小鼠肝脏COPII介导的分泌实验确证了IRE1/XBP1通路对肝脏COPII分泌基因的转录表达及COPII介导的分泌的关键作用。与之相一致,在肝脏特异性的IRE1敲除小鼠中,COPII介导的肝脏载脂蛋白ApoB分泌缺陷、VLDL分泌显著降低,而这直接导致肝脏IRE1敲除小鼠在禁食情况下出现严重的脂肪肝和低血脂症状。在IRE1敲除小鼠的肝脏中重新激活XBP1s可以恢复 COPII介导的脂蛋白分泌,同时逆转脂肪肝和低血脂症状。这项研究揭示了COPII介导的膜泡运输是高度动态变化的,能够响应细胞营养状态的变化;代谢感受IRE1-XBP1通路实现细胞营养状态感知与COPII分泌的偶联。这些发现为脂肪肝等代谢疾病的防治提供了新的线索。
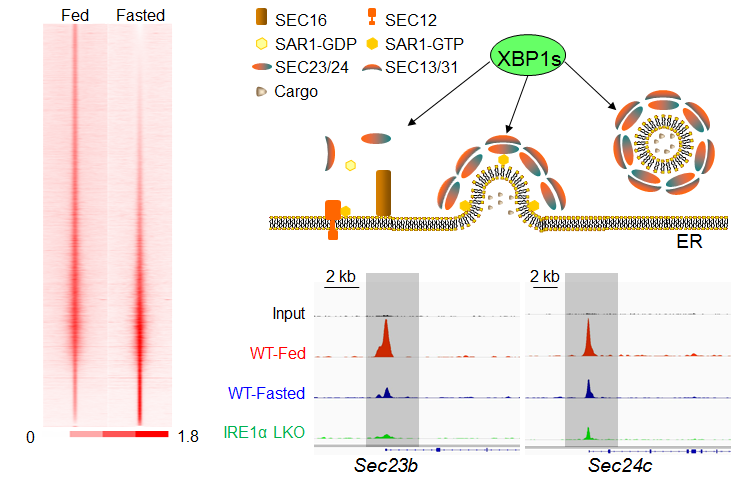
图1. 代谢感受XBP1s动态调控COPII分泌基因表达。
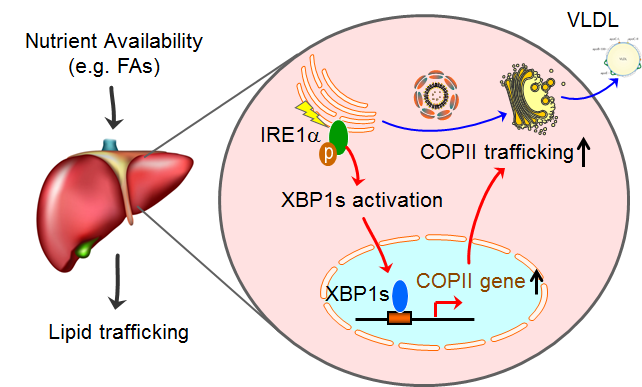
图2. IRE1/XBP1s通路实现肝脏营养状态感知与COPII介导的脂质分泌的偶联。
该项研究得到了国家自然科学基金委、科技部、教育部以及江苏省科技厅等基金的支持,并在相关研究方面得到国内外合作实验室的大力协助与支持。
(模式动物研究所 科学技术处)