化学化工学院朱俊杰教授课题组近期在金属有机框架纳米材料用于癌症多模式治疗研究中取得重要进展,其研究论文“A Catalase-Like Metal‐Organic Framework Nanohybrid for O2‐Evolving Synergistic Chemoradiotherapy”于2019年5月2日在线发表于《德国应用化学》(https://doi.org/10.1002/anie.201902612),这项工作是朱俊杰课题组和美国国立卫生研究院陈小元课题组合作完成的。化学化工学院何智梅博士、生科院王晨博士和南昌大学黄小林博士为共同一作,朱俊杰教授、澳门大学代云路教授,美国国立卫生研究院喻国灿博士和陈小元教授为论文的共同通讯作者,37000cm威尼斯为第一通讯单位。
近年来,朱俊杰教授与陈小元教授合作在生物标志物检测、纳米诊疗方面取得了系列进展(Theranostics 2018, 8, 3461–3473; Small 2019, 15, e1804131)。在快速生长的肿瘤附近,畸形血管供氧不足,形成了肿瘤组织严重缺氧的特点。进一步地,乏氧会诱导肿瘤的迁移、侵袭和转移,并制约光动力治疗、放疗等需氧治疗的疗效。为了提高乏氧细胞对放疗的敏感性,可从以下两方面着手:1)提高肿瘤处氧气含量;2)基于高原子序数元素(如Au、Bi、Hf等)的材料具有较大的X射线能量衰减系数,可以有效地将X射线能量沉积在肿瘤处,从而最佳地利用放疗辐射。
在临床上,放疗通常与其他治疗手段如手术或化疗联用以有效铲除肿瘤,防止肿瘤的复发。目前,尽管关于协同治疗已有大量研究报道,但是由于肿瘤对治疗的抗性,大多数的抗肿瘤效果欠佳。
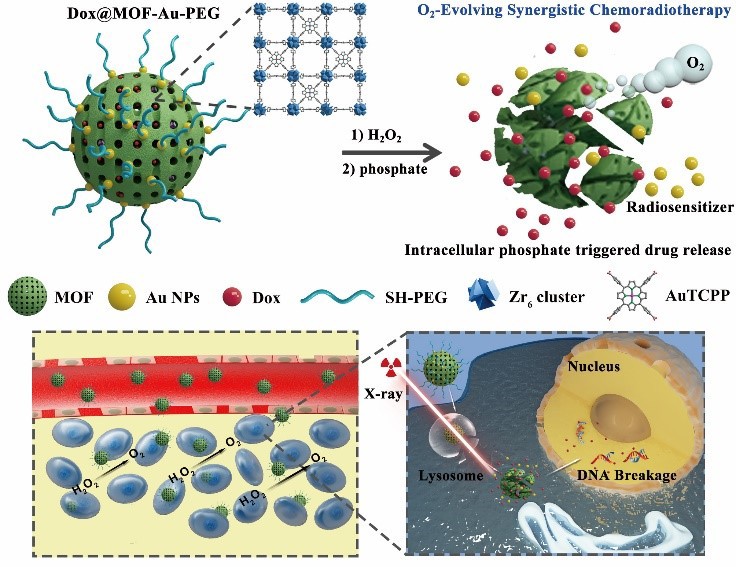
为了克服这一难题,两个课题组密切合作,提出原位催化产氧策略,基于卟啉金属有机框架材料(MOF)@金纳米颗粒(AuNP)纳米复合物(MOF-Au),实现氧气增强的放疗和化疗联合治疗。在这个工作中,金纳米颗粒修饰具有以下优点:1)增敏乏氧癌细胞对X射线的响应性;2)赋予MOF相对稳定性,防止在递送过程中的过早降解;3)使得MOF具有类过氧化氢酶的活性,有效催化肿瘤代谢产物H2O2生成氧气,提高氧气依赖的放疗疗效。该MOF-Au仍具备MOF的高度有序多孔结构,用于抗癌药物盐酸阿霉素的高效负载。体外和体内研究证实,装载有药物的MOF-Au纳米复合物具有放疗增敏效应,能缓解肿瘤处乏氧,显著抑制肿瘤生长,降低系统毒性,为多模式癌症治疗提供了一种新颖的策略。
此项研究工作得到了国家自然科学基金(21834004, 21427807)、科技部国际合作基金(2016YFE0130100)和博士后科研基金(2018M640472)等经费的资助。
(化学化工学院 科学技术处)