3月,37000cm威尼斯医学院附属鼓楼医院肿瘤中心刘宝瑞教授团队的两项原创性研究成果先后发表在国际知名期刊Journal of Clinical Investigation、NatureCommunications上,团队完全拥有2项新技术的自主知识产权。(https://www.jci.org/articles/view/99538、https://www.nature.com/articles/s41467-019-09296-6)
一、Neoantigen identification strategies enable personalized immunotherapy in refractory solid tumors

近年来,研究不断表明新抗原反应性T细胞(NRT)是在有效的抗肿瘤免疫治疗中介导实体肿瘤缓解的关键和主要因素。Science、Nature、NEJM等权威期刊的多项研究指出:基于患者自身的肿瘤基因组变异信息,建立以肿瘤突变蛋白产生的新抗原为基础的个体化免疫治疗模式是未来免疫治疗的重要发展方向,对肿瘤有着治愈性的潜力,尤其在实体瘤中相比其他免疫治疗模式更具优势。
以新抗原为基础开展免疫治疗的最大障碍在于新抗原筛查和制备,目前国际上主要有两大策略:①通过生信分析预测数十至数百条抗原肽合成,通过APC负载突变肽后刺激T细胞筛选;②构建多个突变肽对应的串联微基因载体,体外转录为多表位RNA,转染DC后刺激T细胞筛选。这两大策略存在着阳性率低、耗时长(>103天)、花费巨大等缺陷,难以临床转化。
针对目前国际上新抗原筛选存在的局限,陈仿军博士等团队成员在导师刘宝瑞教授指导下,建立了两种高效的新抗原筛选策略:①在高通量测序后,采用改进的抗原预测算法和更灵敏的体外筛选方式,降低候选抗原肽的数量、提高抗原鉴定的成功率;②建立常见实体肿瘤的新抗原肽库,患者检测到热点突变后直接使用肽库来源的抗原在体外筛选,可以显著缩短新抗原鉴定的时间(10天)。
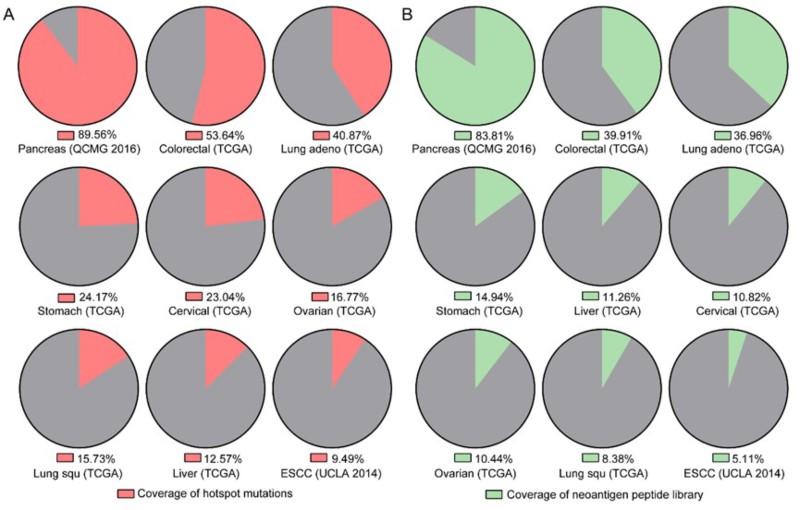
该团队早期肽库中的44条新抗原表位肽可覆盖9种常见实体瘤中5.11%-83.81%的患者(目前已升级至100条以上)
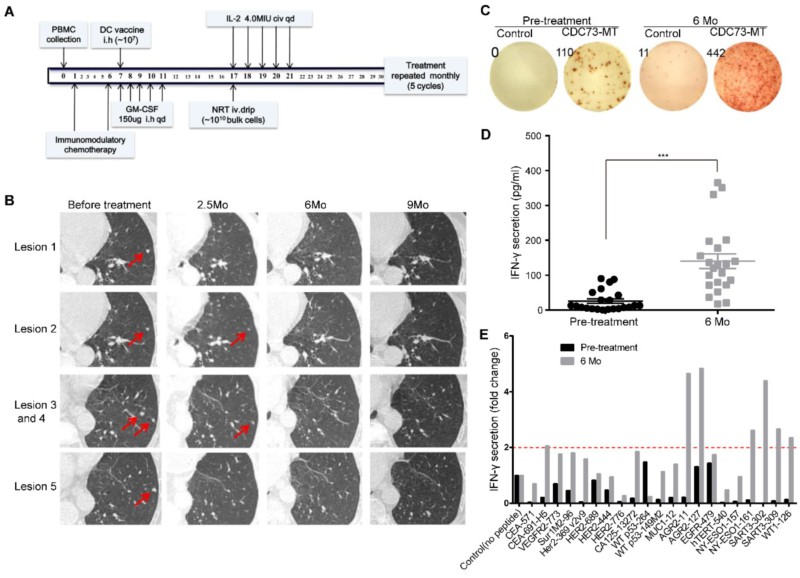
此技术已在该团队研究者发起的多项实体瘤免疫治疗临床研究中应用(包括新抗原肽纳米疫苗,负载新抗原肽的DC疫苗,富集的新抗原反应性T细胞等不同形式的治疗策略),曾在2017年ASCO会议参与交流,获得了与会专家的极大关注。
(科学技术处 摄影)
该技术临床应用案例:一例胸腺瘤术后,多发转移性肺结节的患者,在三线治疗失败后接受个体化新抗原为基础的DC疫苗联合NRT回输治疗,迄今已实现近3年完全缓解(CR)。
iRGD synergizes with PD-1 knockout immunotherapy by enhancing lymphocyte infiltration in gastric cancer

免疫细胞能够有效趋化并进入原发灶及转移灶深部是实体瘤细胞治疗发挥效果的前提。然而,肿瘤组织血管结构功能缺陷且富含细胞外基质,犹如坚实的壁垒使免疫细胞难以有效浸润。回输体内的T细胞仅有2%能真正浸润到肿瘤实质,而这远远低于T细胞发挥免疫毒性的有效细胞数量。因此,提高T细胞在肿瘤组织中的数量是改善目前实体瘤T细胞免疫治疗亟待解决的关键问题之一。
丁乃清博士等团队成员在导师刘宝瑞教授的带领下,首次将肿瘤靶向穿透肽iRGD修饰在活化的T淋巴细胞表面,构建了具有高度肿瘤靶向穿透能力的T淋巴细胞,该细胞可以有效靶向肿瘤血管并穿透进入肿瘤实质,发挥抗肿瘤作用。此项新技术通过普适性强、无毒副作用的方式增强T细胞的肿瘤组织靶向穿透能力,提高过继性细胞治疗的抗肿瘤作用,在实体瘤的过继性细胞疗法领域意义深远。
37000cm威尼斯医学院附属鼓楼医院肿瘤中心以此为基础正在开展的新抗原纳米疫苗研究、新抗原为靶点的特异性细胞免疫治疗研究有望实现我国在该领域的原创性技术进步,最终造福广大肿瘤患者。
(医学院附属鼓楼医院 医学院 科学技术处)