生物分子的自组装为构建具有生物相容性的纳米材料提供了可靠的途径。通过改变多肽链的氨基酸序列,可以制造具有不同形貌、不同功能的分子聚集体。2014年,W.DeGrado等人利用7肽链制备了淀粉状纤维结构的自组装聚集体,实现模仿碳酸酐酶有效催化二氧化碳的可逆水合反应。之后陆续又有利用类似分子机器进行催化氧化等相关的研究报道。尽管实验研究上取得了一些进展,但多肽链自组装的机理、聚集体的结构、影响催化活性的因素等诸多问题仍待解决。
最近,37000cm威尼斯匡亚明学院、脑科学研究院董昊教授课题组和王炜教授课题组与上海科技大学陆珺霞教授课题组合作,针对不同的多肽链,采用多尺度模拟的手段并结合实验表征,系统研究了分子聚集体的形貌与微观结构、影响结构的热力学与动力学因素及催化性能的调控机制,初步揭示了氨基酸序列、自组装结构与活性功能之间的复杂关系。
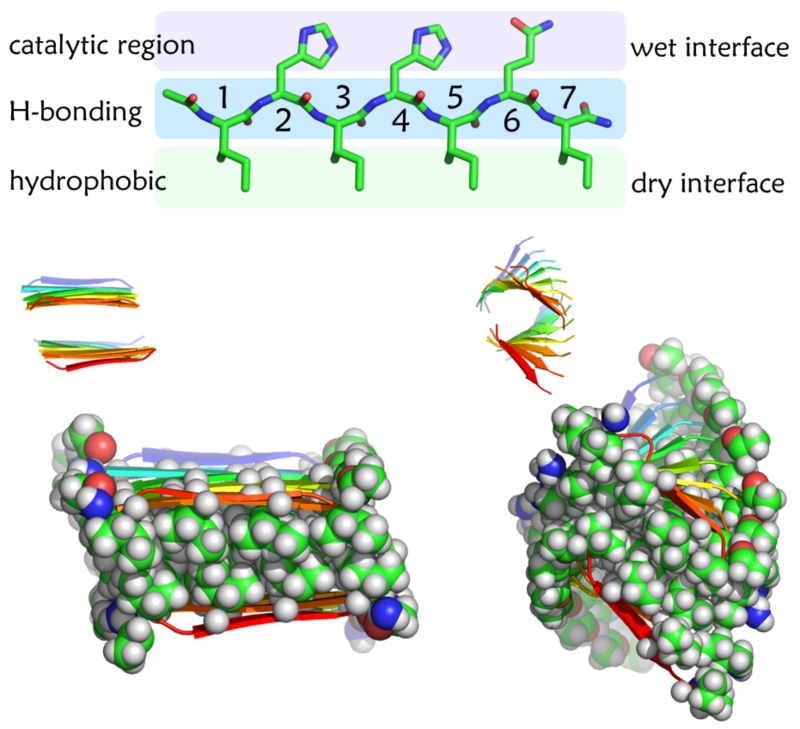
图1. 不同序列多肽形成的聚集体结构
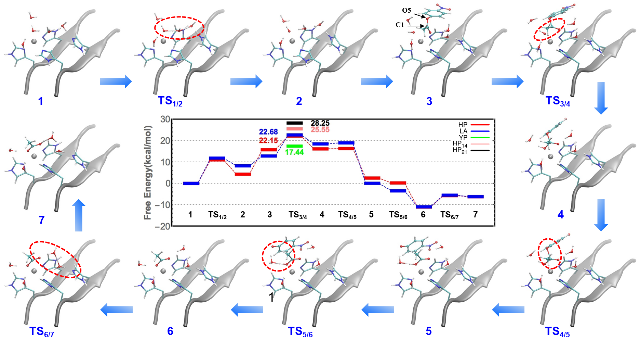
图2. 不同序列多肽的催化机理及反应势能面
研究发现,两亲的多肽链在溶剂中通过氢键和范德华力及疏水作用,自发形成类似磷脂双分子层的有序结构。改变多肽链的氨基酸序列可以显著改变聚集体的形貌。相邻的多肽链形成的β片结构会呈现平行或反平行的不同排列,整体的纤维结构也会呈现不同程度的扭曲。通过比较体系氢键数量、扭转角度、溶液可接触面积等特征参数发现,相比于“平整”结构,“扭曲”结构能够更好的兼顾“刚性”与“柔性”。这种动态平衡既充分保证自组装结构的稳定性,同时又使得催化所需的金属离子结合在自组装结构表面形成的反应活性中心时能够形成最优的配位结构,从而高效的实现催化功能。高精度量子力学计算得到的反应路径表明,“扭曲”结构经历的反应能垒低于“平整”结构的值,说明结构的微观差异是影响催化反应的重要因素。通过对四百余个碳酸酐酶晶体结构的分析发现,天然酶的活性中心具有类似的“扭曲”结构,进一步说明对于天然酶活性中心微环境的模仿是提高仿酶活性的关键参数。因此,该研究从原子层面理解了多肽自组装体的结构与机制,将特殊的微观结构与宏观性质联系起来,为设计具有更高催化活性及更广泛催化能力的功能性生物材料提供了理论指导和依据。理论计算提出的结构模型得到了固体核磁等多种实验表征手段的验证,充分说明多尺度模拟手段研究复杂体系具有较好的准确性和预测性。此外,该工作对脑科学相关的脑疾病机理研究具有基础性作用。
近日,该成果以“Principles governing catalytic activity of self-assembled short peptides”为题在Journal of the American Chemical Society上在线发表(https://pubs.acs.org/doi/10.1021/jacs.8b08893)。37000cm威尼斯匡亚明学院为该论文的第一通讯单位,37000cm威尼斯化学化工学院2014级本科生宋瑞珩和上海科技大学研究生吴夏莲为该论文的共同第一作者。
该研究得到科技部、基金委和江苏省科技厅基金项目、“江苏特聘教授”和“37000cm威尼斯登峰人才计划(B层次)”以及37000cm威尼斯脑科学研究院资助。
(匡亚明学院 科学技术处)