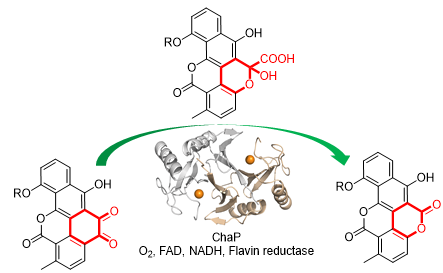
图片摘要
由细菌合成的多环芳香聚酮类化合物是抗肿瘤、抗菌药物的重要来源,典型的例子包括阿霉素、四环素等。这类分子的基本碳骨架大多由细菌的II型聚酮合成酶(Type II PKS)负责构建,但后期的各类氧化重排反应是此类分子结构和生物活性多样性的关键,理解氧化重排的酶学机制,对于它们的结构以及构效关系的研究至关重要。Chartreusin是一种从放线菌中发现的强效抗肿瘤候选药物,它可与DNA结合,通过自由基断裂DNA,进而诱导肿瘤细胞凋亡。尽管Chartreusin的生物合成基因簇早在2005年就已被德国科学家Christian Hertweck研究组克隆鉴定,但其具体的合成步骤特别是关键的氧化重排反应依然不明。
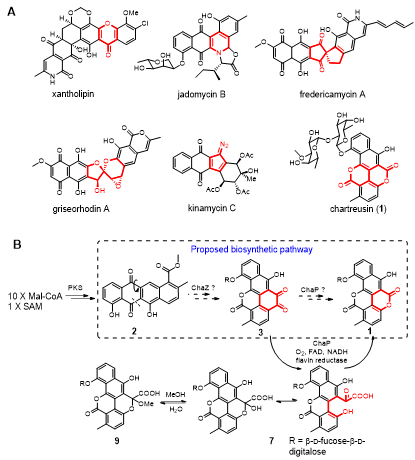
Figure 1. A) Examples of natural products synthesized by type II PKSs where oxidative rearrangement (highlighted in red) play a key role in generating structural complexity. B) Biosynthesis of chartreusin (1)
近日,37000cm威尼斯生命科学学院医药生物技术国家重点实验室的戈惠明和谭仁祥研究团队揭示了chartreusin生物合成末期的一关键的氧化重排反应的酶学机制。该研究成果以Molecular Basis for the Final Oxidative Rearrangement Steps in Chartreusin Biosynthesis于2018年8月1日在线发表于《美国化学会志》(Journal of the American Chemical Society),论文链接为http://dx.doi.org/10.1021/jacs.8b06623。
研究人员从一高产chartreusin的海洋放线菌出发,通过对其生物合成相关基因的敲除,合成中间体的分离、鉴定,化学回补以及异源生物转化等方法,确定了五环邻醌化合物(2)为关键中间体,并且从2到最终产物chartreusin(1)的转化是由一双加氧酶(dioxygenase)ChaP介导的。
然而,在体外反应中,ChaP蛋白却未能将化合物2转化为化合物1。分析显示,ChaP属于Vicinal Oxygen Chelate(VOC)蛋白超家族,该超家族的蛋白功能多样,其中catechol 2,3-dioxygenase可催化儿茶酚上与酚羟基相邻的碳碳键的断裂,研究人员推测,ChaP很有可能与catechol 2,3-dioxygenase催化反应的断键方式类似,但不同点在于:儿茶酚化合物比邻苯醌化合物多了2个电子。最后,研究人员发现ChaP的催化需要黄素(FAD)和黄素还原酶(flavin reductase)的参与,即需要黄素活化的氧(Fl-OOH)而非普通的氧气作为此反应的氧化剂,但有趣的是,ChaP未能预测出黄素的结合位点。
为进一步研究该反应的催化机理,研究人员获得了ChaP蛋白的晶体,经分子对接和点突变实验,阐明了此类新型氧化酶的反应机制,即:底物2中的两个酮羰基与ChaP中的二价铁结合后,FAD活化的过氧化氢进入活性中心,断裂C-C键,生成IV;紧接着,另一分子过氧化氢进入活性中心,发生第二次C-C键断裂,放出一份子二氧化碳,并关环形成最终产物1。


Figure 2. Structures of ChaP and its homologous enzymes and proposed catalytic mechanism. The dimeric structure of ChaP (PDB: 6A4Z) (A), ChaP-H1 (PDB: 6A52) (B), and ChaP-H2 (PDB: 6A4X) (C), (D) superimposed image of ChaP (wheat), and its homologs ChaP-H1 (yellow) and ChaP-H2 (aquamarine) and their symmetric monomer was marked as light gray. (E) Colored surface of ChaP and the putative substrate position by docking. The molecular surface was colored by amino acid hydrophobicity according to the Kyte-Doolittle scale: the hydrophobicity scale from least to most was colored blue to orange to red with zero hydrophobicity colored as white. (F) Amino acid residues in ChaP that form the active site. Residues from two monomers were colored in gold and silver, respectively. (G) Proposed mechanism for ChaP-catalyzed reaction.
37000cm威尼斯生命科学学院博士研究生王以爽和助理研究员张博是该论文的共同第一作者,37000cm威尼斯戈惠明教授、谭仁祥教授和南京中医药大学朱家鹏教授是论文的共同通讯作者;主要合作者包括:上海科技大学赵素文教授,37000cm威尼斯化学化工学院梁勇教授、刘芳博士,以及中国科学院热带农业研究院的黄慧琴教授等。该工作得到国家自然科学基金委优青项目、重点项目、面上项目以及中央高校基本科研业务费等的资助,在此表示感谢。
(生命科学学院 科学技术处)