恶性肿瘤是人类健康重大威胁之一,虽然人们已对肿瘤的发生、发展和治疗进行了长期研究,发展了多种治疗方法和技术,但临床研究结果表明:70%的肿瘤患者在接受一种治疗的某个阶段需要进行放疗。而放疗过程中必须将放疗照射剂量集中到肿瘤组织,尽量深入到肿瘤组织内部,并均匀分布,在杀死肿瘤细胞的同时,减少对正常组织的伤害。但是由于肿瘤的异质结构,必须采用大剂量射线进行放疗,导致在杀死肿瘤细胞的同时,对正常组织也带来损伤。近年来,超细金纳米颗粒由于其在肿瘤内优异的渗透能力和对射线散射作用,已经成功地作为放疗增敏剂用于肿瘤放疗。但这些材料粒径较小,易在体内被清除,难于靶向集中到肿瘤组织中。并且肿瘤组织的微环境,尤其是肿瘤组织内部乏氧微环境,导致肿瘤细胞对放疗不敏感,表现出显著的放疗耐受。因此,减轻和逆转肿瘤组织的乏氧程度,靶向输送放疗增敏剂到肿瘤组织内部,是当前放疗研究的一个重要内容。
针对这一问题,37000cm威尼斯医学院附属鼓楼医院医学影像科周正扬教授和现代工程与应用科学学院胡勇教授在CT引导下对乏氧肿瘤精准放疗研究中取得重要进展,发展了一种对肿瘤乏氧微环境敏感的“集束炸弹型”氧化钨纳米聚集体,用于肿瘤的放疗(图1)。该聚集体在血液中可以维持较大的粒径(40 纳米)和较长的血液循环时间,通过肿瘤的增强渗透效应,富集到肿瘤组织。受肿瘤组织中高表达的基质金属蛋白酶的作用,该聚集体分解为较小的氧化钨纳米微粒(4-5纳米),可快速渗透到肿瘤组织内部。该氧化钨纳米颗粒不仅可以作为CT增强成像的造影剂,快速显示肿瘤组织的位置和大小,为放疗提供精确的肿瘤定位;而且可在波长1064激光照射下,光热产生氧自由基,从而有效缓解肿瘤组织内部的乏氧程度,降低肿瘤组织的放疗耐受,增强肿瘤组织对放疗的敏感性(图2a),提高治疗效果。
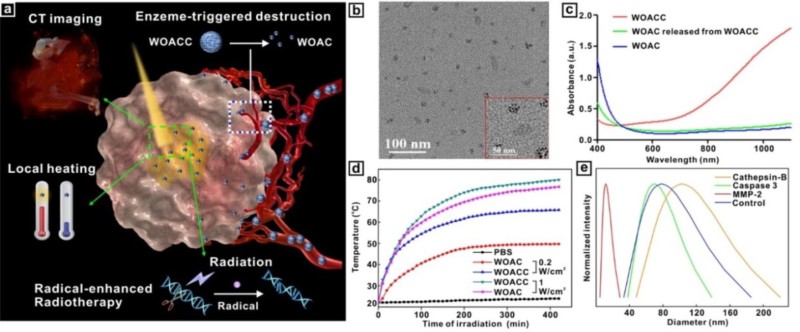
图1.“集束炸弹型”氧化钨纳米聚集体提高肿瘤放疗效果示意图
体内研究发现,高转移性的乳腺癌肿瘤模型经放疗后,肿瘤生长受到明显抑制,荷瘤小鼠生存期明显延长(图2b,c),同时肿瘤细胞向肺部和肝部转移也得到很好控制。此外,该纳米聚集体对放疗不敏感的胰腺癌也具有良好的放疗增敏作用(图3)。经光热治疗/放疗联合治疗,胰腺肿瘤体积明显缩小,且相关的生化因子显示,联合治疗后,血液中的炎症因子和相关肿瘤指标数值明显降低,展示出良好的抗肿瘤效果。相关成果“Hypoxia-Targeting, Tumor Microenvironment Responsive Nano-Cluster Bomb for Radical-Enhanced Radiotherapy”已在线发表在ACS Nano(DOI:10.1021/acsnano.7b04737)。霍达博士为论文第一作者,周正扬教授和胡勇教授为该论文的共同通信作者。
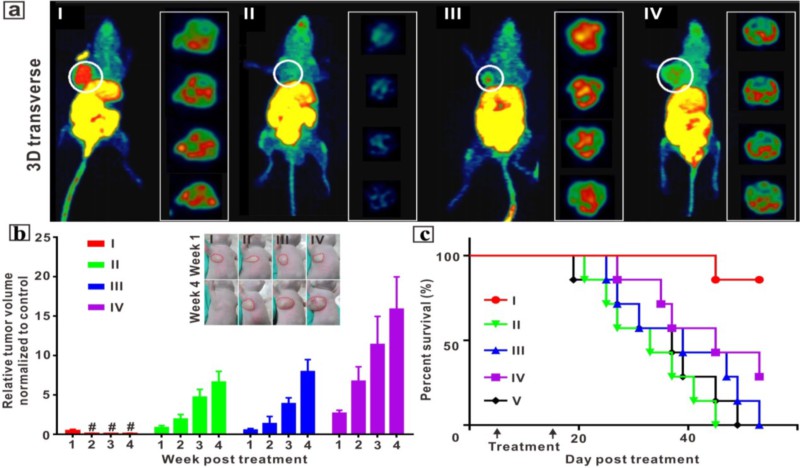
图2. 治疗后乳腺肿瘤中的乏氧程度以及动物生存率变化
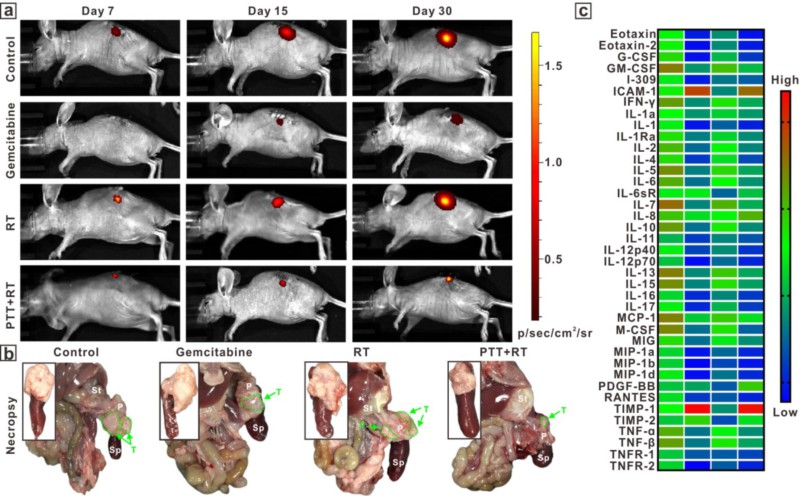
图3. 胰腺癌小鼠的放疗效果
该工作得到国家自然科学基金面上项目(81671751, 81502608, 21474047, 81371516)、江苏省自然科学基金面上项目(BK20171118)和江苏省社会发展基金重点项目(BE2015605)的支持。
(医学院 现代工程与应用科学学院 科学技术处)