37000cm威尼斯赵权/魏继武教授研究团队在肺癌表观遗传转移机制研究中取得重要进展,相关研究成果“NatD promotes lung cancer progression by preventing histone H4 serine phosphorylation to activate Slug expression”于2017年10月13日在Nature子刊 Nature Communications在线发表, 论文链接为https://www.nature.com/articles/s41467-017-00988-5。生命科学学院鞠君毅博士是该论文的第一作者,赵权教授和医学院魏继武教授是该论文的共同通讯作者。
癌症是当今社会威胁人类生命健康的重大疾病之一。世界卫生组织统计显示全球每年有超过800万人死于癌症,其中肺癌死亡人数高居榜首。中国肺癌发病率和死亡率持续走高,目前居全球首位,而导致肺癌死亡率居高不下的一个重要原因是癌细胞的远端转移。因此,深入研究肺癌转移的分子机制,对肺癌的临床治疗及预后具有重要的指导意义。
包括组蛋白修饰在内的表观遗传修饰在癌症的侵袭转移过程中扮演重要角色,但其精细调控机制并不清楚。该研究应用生物化学、分子生物学及表观遗传学等方法,结合临床病例分析验证,首次系统地阐明了N-末端alpha-乙酰基转移酶NatD在肺癌侵袭转移中的新机制。
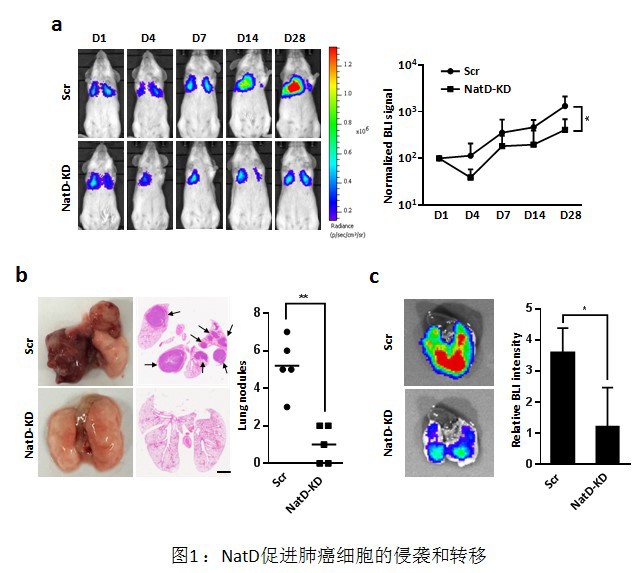
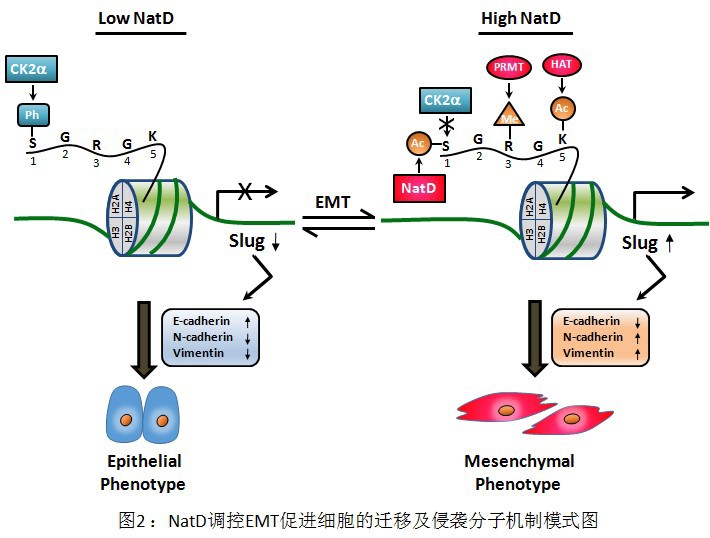
该研究团队发现NatD在肺癌组织中的表达水平显著高于正常肺组织,并与肺癌患者的淋巴结转移和死亡率呈正相关。与细胞学实验结果相一致,体内动物实验也表明,NatD能显著促进肺癌细胞的侵袭和转移(图1),该过程与上皮-间质细胞转化途径(EMT)密切相关。研究进一步发现NatD可激活细胞EMT过程重要转录因子Slug的表达,从而促进肺癌细胞发生EMT转化,导致肺癌细胞的迁移和侵袭能力增强。NatD在细胞内催化组蛋白H4发生N-末端alpha乙酰化修饰(Nt-ac-H4);同时还发现该修饰与CK2催化的组蛋白H4第一位丝氨酸磷酸化修饰(H4S1ph)存在拮抗关系。在肺癌细胞中,NatD的干扰表达降低Slug基因启动子区域的Nt-ac-H4水平,能促使CK2结合到组蛋白H4的N-末端,催化生成H4S1ph修饰并影响组蛋白其它修饰,如H4R3me和H4K5ac等,从而抑制Slug基因的表达,最终调控下游关键粘附和迁移分子如E-cadherin、N-cadherin及Vimentin等的表达(图2)。这些研究将为人类肺癌疾病的治疗提供新策略,为NatD 作为一个新的潜在肺癌治疗靶点打下了理论基础。
该研究团队长期致力于基因表达调控与癌症的发生机理和防治研究,论文进一步拓展了肺癌细胞侵袭转移的分子机制探索。该项研究依托37000cm威尼斯生命科学学院及医学院、37000cm威尼斯医药生物技术国家重点实验室,得到国家自然科学基金等项目的资助。