基因干扰技术在人类疾病治疗中具有重要应用前景。该技术利用特定载体将siRNA运载到靶细胞中,选择性地沉默目标基因,从而抑制蛋白质的合成、诱导细胞凋亡,实现疾病治疗。将siRNA高效、高特异性地运载到目标细胞是实现基因干扰治疗的关键。
传统的siRNA运载体系常用抗体或核酸适体为识别分子,与细胞表面单种受体结合,实现靶向功能。由于肿瘤细胞表面高表达的受体在正常细胞表面也可能表达,采用单受体识别难以保证运载的精准靶向。针对这一关键问题,我校生命分析化学国家重点实验室的鞠熀先教授研究组利用核酸适体sgc8c和sgc4f与细胞表面两种特定的受体结合,形成双锁结构,发展了一种双受体介导的siRNA运载体系,成功实现了细胞亚型的区分,以及低毒、高效的siRNA运载。该方法通过DNA自组装,首先设计合成了一个含siRNA的核酸纳米载体,其一端为发夹结构。发夹的环部是锌离子依赖性DNA酶的底物。该载体具有血清稳定性好、细胞毒性小、运载能力以及内涵体逃逸能力高的优点。在载体与细胞表面结合的sgc8c和sgc4f相遇时,核酸适体sgc4f一端的锌离子依赖性DNA酶可将载体上的发夹结构催化裂解,形成一条DNA单链。该单链进一步打开核酸适体sgc8c上的发夹,通过sgc8c的介导,将siRNA运载到靶细胞中(图1)。对于只能结合sgc8c或sgc4f一种核酸适体的细胞,该运载系统没有活性,因而减小了脱靶毒性。该策略为高效、高特异性siRNA运载以及癌症的精准治疗提供了新的思路。
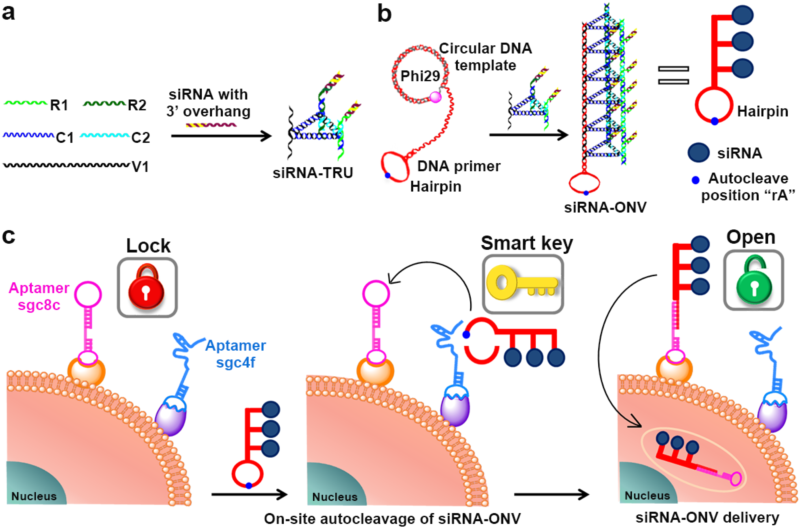
图1. 双受体介导的细胞亚型特异性siRNA运载示意图
这一成果由任克维博士后、刘颖教授为共同第一作者,鞠熀先教授为通讯作者完成,并以“A DNA dual lock-and-key strategy for cell-subtype-specific siRNA delivery”为题于11月24日在Nature Commun. DOI: 10.1038/ncomms13580在线发表。
鞠熀先教授研究组近年来专注癌症相关功能分子的原位检测方法学和癌症精准诊疗一体化研究,并取得连续进展。他们设计了多种由细胞表面受体(Angew. Chem. Int. Ed., 2014, 53, 9544; Chem. Commun. 2015, 51, 10831)、细胞内pH(J. Am. Chem. Soc., 2013, 135 18850; Chem. Sci., 2015, 6, 5969)、ATP(Nanoscale, 2015, 7, 15953-15691)、microRNA (ACS Applied Mater. Interf., 2015, 7, 19016)、cathepsin B (Anal. Chem. 2015, 87, 3841)等介导的精准治疗技术,提出了现场疗效监测的新思路和治疗机制研究的新手段,已引起广泛关注。
(化学化工学院 科学技术处)