近日,由我校籍晓云教授与天津大学、南开大学等校的研究人员组成的科研团队揭开了寨卡病毒复制的奥秘。相关研究成果以“Structural basis of Zika virus helicase in recognizing its substrates”为题,发表在《Protein&Cell》杂志上(DOI 10.1007/s13238-016-0293-2),籍晓云教授为共同第一作者。
近年来在南美洲和拉丁美洲肆虐的寨卡病毒越来越引起人们的重视和广泛关注。寨卡病毒感染除了能够造成新生儿小头畸形,还能引发严重的神经系统疾病格林-巴利综合征,导致患者瘫痪甚至死亡。目前寨卡病毒复制的过程及机理仍待探究。病毒复制几乎都需要一种被称之为“解旋酶”的蛋白质。寨卡病毒解旋酶是一种“马达”蛋白,它通过水解三磷酸核苷将化学能转换为机械能,从而实现对双链核酸的解链功能。病毒只有将双链核酸解链后,才能将单链遗传物质进行复制,实现增殖。寨卡病毒疫情在全球范围内迅速扩散,国际上众多科学家纷纷开展针对其复制机理和药物开发的相关研究。面对激烈的国际竞争,以我校作为主要完成单位的联合科研团队早在2016年5月于《Protein&Cell》杂志上发表题为“The crystal structure of Zika virus helicase: basis for antiviral drug design”(籍晓云教授为共同第一作者)的文章,率先报导了寨卡病毒解旋酶高分辨率的三维空间结构,为抗寨卡病毒的药物研发奠定了重要的结构基础。日前,该科研团队在5月发表工作的基础上,又获得了突破性的新进展,率先揭示寨卡病毒复制过程中这一关键步骤的分子机制,保持了领先优势。这将促进抗寨卡病毒的药物研发,抵御该病毒在全球范围内的巨大威胁。
该科研团队利用X光单晶衍射技术,在原子分辨率水平解析了寨卡病毒解旋酶、三磷酸腺苷(ATP)和金属催化离子形成的三元复合物的空间结构。在研究过程中,他们成功捕捉到了寨卡病毒解旋酶结合ATP以及金属离子的中间态。这也是首次捕捉到黄病毒属(包括登革热病毒、黄热病毒、西尼罗病毒等)的解旋酶结合其天然底物ATP的中间体。通过对这一精细结构的分析,联合科研团队揭示了寨卡病毒解旋酶如何识别ATP和金属催化离子的精确机制。
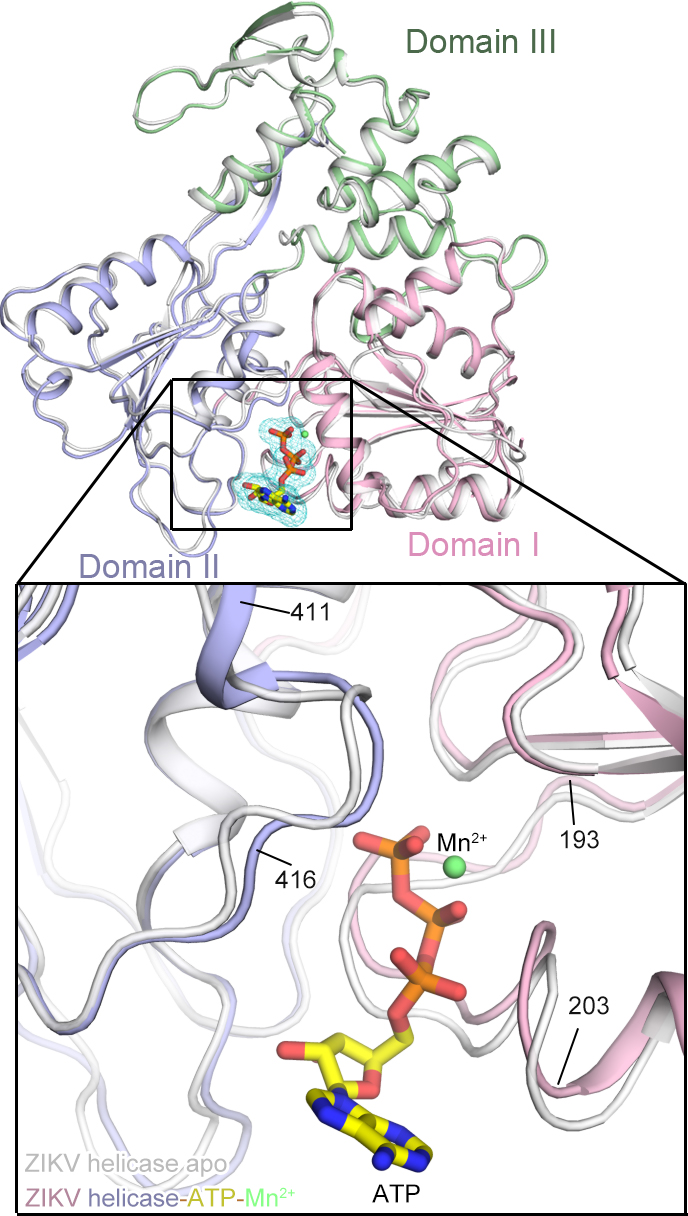
图注:寨卡病毒解旋酶、三磷酸腺苷(ATP)和金属催化离子形成的三元复合物的三维结构
为了探究寨卡病毒与其他黄病毒属成员在复制机制上的差异,团队研究人员又解析了寨卡病毒解旋酶结合其自身基因组RNA的复合物三维结构。他们发现寨卡病毒解旋酶在结合RNA后因为其结构域发生旋转运动,会引发较大的构象变化。更令研究人员吃惊的是,寨卡病毒解旋酶的这种构象变化与登革热病毒解旋酶截然不同。通过这一现象,他们认为黄病毒属解旋酶在进化过程中演化出一种保守的分子“马达”,它可以通过水解三磷酸核苷将化学能转变为机械能,用于实现病毒复制过程中的“解链”;然而利用不同的“运动”模式,各种病毒的解旋酶又可以差异性的识别自身的基因组RNA,用于满足不同病毒复制的需要。在这一过程中,大自然巧妙的将“趋同”和“趋异”这两种进化模式高度的统一起来。
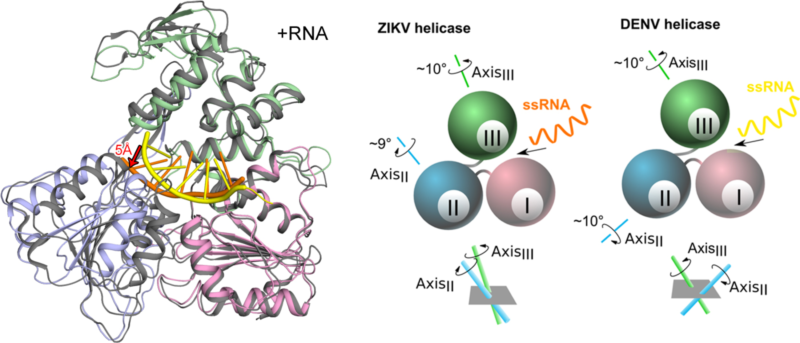
图注:寨卡病毒和登革热病毒的解旋酶以不同的“运动”方式结合自身的基因组
由Springer出版的《Protein&Cell》对我国科学家关于寨卡病毒研究的最新进展进行了详细介绍。国外包括Science daily、EurekAlert AAAS Science News、ANI、Yahoo等在内的数十家媒体,国内包括新华社、《光明日报》、《科技日报》、《中国科学报》、人民网、新浪网、搜狐网等媒体,报道了此项成果。
此项工作得到籍晓云教授专项经费的支持。
相关文章:
Tian H*, Ji X*, Yang X*, Zhang Z, Lu Z, Yang K, Chen C, Zhao Q, Chi H, Mu Z, Xie W, Wang Z, Lou H, Yang H, Rao Z. (2016) Structural basis of Zika virus helicase in recognizing its substrates. Protein & Cell. 2016:1-9. (*equal contribution)
Tian H*, Ji X*, Yang X*, Xie W, Yang K, Chen C, Wu C, Chi H, Mu Z, Wang Z, Yang H. (2016) The crystal structure of Zika virus helicase: basis for antiviral drug design. Protein & Cell. 2016:1-5. (*equal contribution)
(生命科学学院 科学技术处)