我校化学化工学院,生命分析化学国家重点实验室朱俊杰教授研究团队在基于纳米技术的肿瘤诊疗研究方面取得重要进展,相关研究成果以“Gold-Nanosponge-Based Multistimuli-Responsive Drug Vehicles for Targeted Chemo-Photothermal Therapy”为题,发表在国际著名期刊《Advanced Materials》 上(DOI:10.1002/adma.201602486,7月27日)。我校2015年毕业学生郑婷婷博士为论文第一作者,37000cm威尼斯为第一作者单位,朱俊杰教授和美国南卡来罗纳大学王辉博士为通讯作者。
朱俊杰教授的研究团队近年来在基于纳米技术的肿瘤诊疗领域取得了一系列研究成果,他们发展了以杂化DNA结构为纳米门的介孔硅纳米载体(Angew. Chem. Int. Ed.,2014, 53,2371)、多组分DNAzyme原位扩增技术的纳米器件(ACS Nano, 2015, 9, 789)、 温度响应的智能纳米载体(ACS Nano, 2016, 10,3637)以及用于光动力学治疗的铷掺杂上转换纳米载体(Adv. Funct. Mater., 2016, 26, 4778),并以此成功进行了药物对肿瘤的靶向输运与可控释放的研究。最近该研究团队与美国南卡来罗纳大学王辉博士合作,设计合成了一种集高通量药物装载、肿瘤靶向性识别、多刺激响应释放及近红外光热疗于一体的“金纳米海绵(gold nanosponge)” 载药纳米探针,实现了肿瘤的光、热及化疗协同治疗。这种由刻蚀金铜合金得到海绵状纳米金具有独特的高比表面积三维多孔结构,能大大提高了药物的装载量(图1)。同时由于该纳米金能在近红外区的宽波长共振吸收,可进行局部肿瘤热疗以及精准的光热刺激药物释放。此外,他们也将具有pH和温度双重响应的磷脂高分子层和靶向肿瘤细胞RNA适配体对海绵纳米金进行共修饰,实现了肿瘤细胞及荷瘤小鼠中的定点传输与可控释放(图2),减小了毒副作用,显著提高了治疗效果,这项成果对构建以纳米技术为导向的光、热、化疗一体化平台起到了显著推动作用。
该工作得到国家自然基金委重点项目,仪器项目和37000cm威尼斯优秀博士生提升计划(A)等项目的支持。

图1 金纳米海绵(gold nanosponge)的合成与表征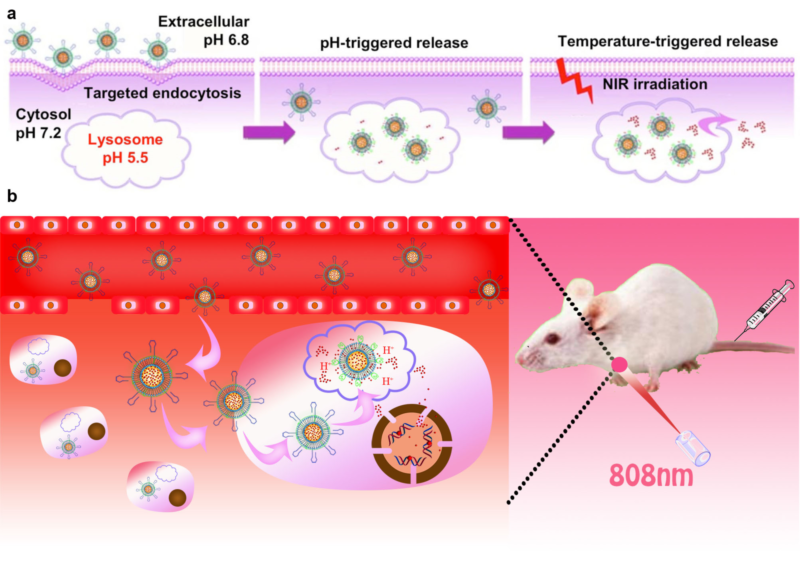
图2 光热载药纳米探针的靶向传输与多刺激响应释放
(化学化工学院 科学技术处)