合成效率最优化是提高合成经济性之关键,更是有机合成研究的永恒主题。依据基元反应机理和动力学因素设计、发展和应用各种串联反应正是基于提升合成效率的考虑。高效的串联反应不仅在化学基础层面展示形成多个共价键过程中各基元反应艺术般的“美妙合奏”,而且在包括天然产物在内的各类重要产品的合成与生产中体现无与伦比的实用价值。化学化工学院姚祝军教授指导的研究组近年来根据其在天然产物Chlorofusin等合成中发现的化学转化效率不稳定问题(Qian, W.-J.; et al. J. Am. Chem. Soc. 2007, 129, 6400; Yao, Y.-S.; et al. J. Org. Chem. 2008, 73, 5221),持续研究了一类具有非经典弱休克尔芳香性的活泼中间体,即苯并异吡喃氧鎓离子(Isochromenylium)的化学特性,从中相继发展了多种不同寻常的高效率碳正离子型串联反应(Hu, Z.-L.; et al. Org. Lett. 2009, 11, 4676; J. Org. Chem. 2009, 74, 8787; Chem. Eur. J. 2011, 17, 1268; Yu, S.-Y.; et al.; Tetrahedron Lett. 2012, 53, 2765; Zhang, H.; et al. RSC Advance 2012, 2, 5101.),为合成和制备多种具有多取代四氢萘核心结构的化合物提供了“一步法”捷径。
由于苯并异吡喃氧鎓离子异常活泼的化学性质,上述串联反应的对映面立体选择性问题一直未能得到解决,而这也将制约这些高效率化学反应在重要药物和化学产品合成中的应用。最近,该组博士生余述燕(今年6月已博士毕业)、张昊、莫磊、以及本校大四学生高扬(今年7月已毕业,现为上海有机所研究生)等组成的专题小组经过较长时间的摸索和方案修正,终于成功实现了第一例苯并异吡喃氧鎓离子介导的催化不对称串联成环反应。该成果今年8月正式发表于国际著名化学刊物“美国化学会会志”(Yu, S.-Y.; Zhang, H.; Mo, Lei; Gao, Y. et al. J. Am. Chem. Soc. 2013, 135, 11402.)。
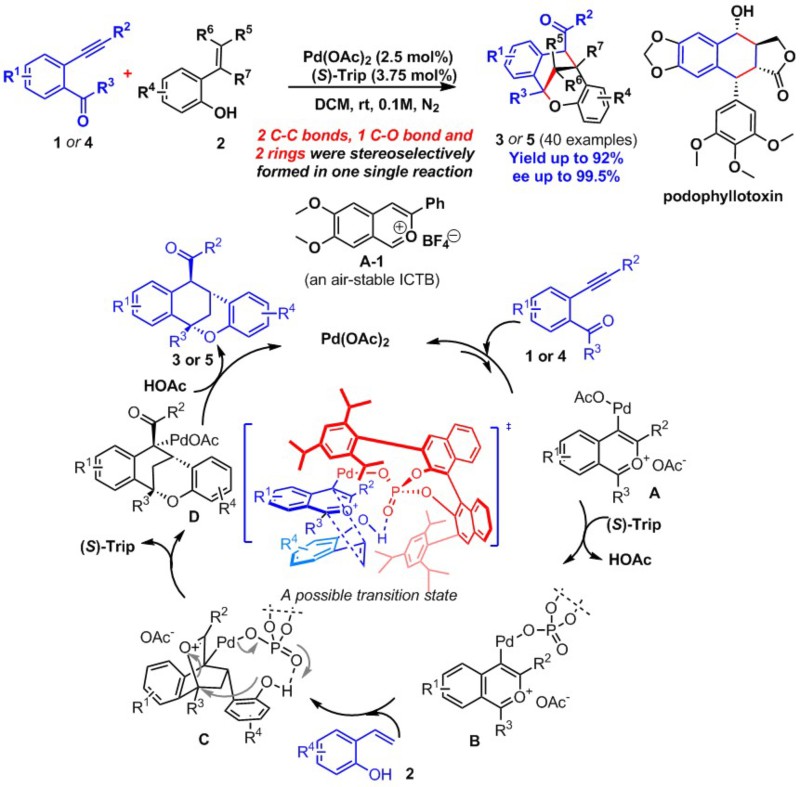
新方法摒弃了以往采用的以空气稳定的苯并异吡喃氧鎓离子盐为反应底物的思路,而精心设计了反应现场以-Lewis酸Pd(OAc)2催化活化底物1中的碳碳三键启动反应,引发分子内羰基-炔烃环异构化产生具有一定寿命的C(sp2)-Pd(II)键的苯并异吡喃氧鎓离子活泼中间体;体系中存在的另一催化剂手性磷酸(S)-Trip依据简单的酸碱置换理论随即取代Pd(II)上的醋酸根离子成为新的配体;由于磷酸中P=O的特性,其又和另一反应底物2中的酚羟基发生氢键缔合作用将之拖入反应体系,从而形成了由两个反应底物和两个催化剂共同组成的一体化超分子反应过渡态。随即引发关键的氧杂Diels-Alder反应(或形式上多步协同的[4+2]-环合反应)实现了对映选择性、区域选择性、endo/exo选择性及非对映选择性的全面控制。报道的40例反应均一次性形成三根新的化学键和两个新的环系,并最多可以产生包括季碳等四个新的手征性中心。其中,最高反应产率可达92%,产物对映过剩值高达99.5%。这类反应均可在室温下完成,仅需2.5mol% Pd(OAc)2和3.75mol% (S)-Trip作为催化剂;并可以克级规模在实验室放大并保持催化效果。
新发展的催化不对称串联构环反应为多取代四氢萘衍生物,如著名的天然药物鬼臼毒素(Podophyllotoxin,PPT)的化学结构多样性研究提供了新技术,可望通过一步法实现对映纯的PPT构象锁定类似物的制备,进而促进抗癌药物研究的开展。
上述研究工作得到了国家自然科学基金委2012年立项的面上项目(编号21272112)的资助,同时还得到科技部等其它基金的共同资助。(化学化工学院)