肿瘤的高效、高选择性治疗是癌症治疗研究的热点。与传统的癌症治疗(手术、放疗、化疗)技术不同,光动力治疗用光激发光敏剂,将能量传递给周围的分子氧(3O2),产生具有瞬时强氧化性的单线态氧(1O2),这种1O2可破坏肿瘤组织和癌细胞,实现癌症的高效治疗。在光动力治疗研究领域,光敏剂的设计与选择是其核心问题。目前临床使用的光敏剂,大多对肿瘤组织或细胞选择性不高,导致肿瘤组织周围的正常组织也受到损伤,而且病人在接受光动力治疗以后仍需长时间避光以减轻皮肤红肿、色素沉着等光毒性反应。因此,寻找新型光敏剂以实现1O2在肿瘤组织和细胞中的选择性释放是光动力治疗技术应用的关键问题。
鞠熀先教授研究组在973计划“仿生分子识别技术在生物医学应用的基础研究”(2010-2014)与国家自然科学基金创新研究群体(2006-2014)和重点项目(2012-2016)等资助下,联合化学化工学院沈珍教授设计了一种在近红外光照射下具有“开-关”可控生成1O2能力的激活型光敏剂,即光敏剂在正常组织中无活性—“不生成1O2”;而在进入肿瘤组织或细胞后被激活—“高效生成1O2”,从而实现肿瘤高效、高选择性地光动力治疗。该设计基于肿瘤组织具有微酸性(pH 6.5-6.8)以及肿瘤细胞表面叶酸受体过表达的生理特点,合成了一种在载体内部包埋pH激活型卟啉光敏剂(NMe2Se4N2)、表面叶酸(FA)功能化的聚合物纳米粒子(FA-NMe2Se4N2 NP)(图1)。该纳米粒子能够特异识别肿瘤细胞表面的叶酸受体并被内吞到肿瘤细胞溶酶体,溶酶体内部低的pH环境(4.5-5.0)激活NMe2Se4N2产生1O2(图2),导致溶酶体膜损坏,诱导肿瘤细胞以溶酶体途径凋亡。该过程对正常细胞未见任何毒副作用(图3)。活体实验表明该纳米粒子在血液中稳定,能够快速靶向至肿瘤组织。近红外光照射后,肿瘤组织的生长被明显抑制,未见其它光敏副作用。该工作为新型智能光敏剂的设计以及肿瘤的高效、高选择性光动力治疗提供了新思路。该成果由该组11级博士生田蒋为和丁霖副教授为共同第一作者,于2013年12月2日以全文形式在《美国化学会志》在线发表(J. Am. Chem. Soc. DOI: 10.1021/ja408286k)。(化学化工学院)

图1. FA-NMe2Se4N2 NP用于肿瘤高效、高选择性光动力治疗示意图
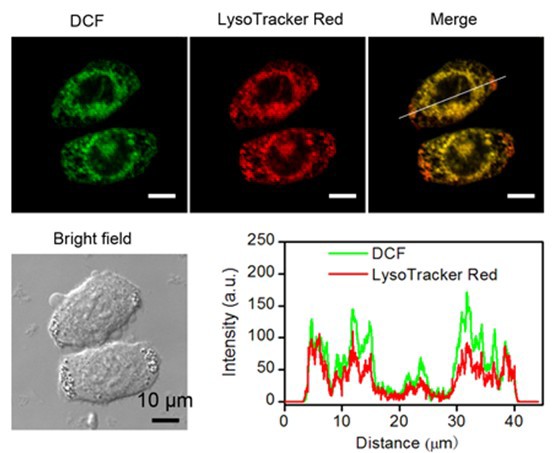
图2. 光动力治疗过程中癌细胞内产生1O2的研究
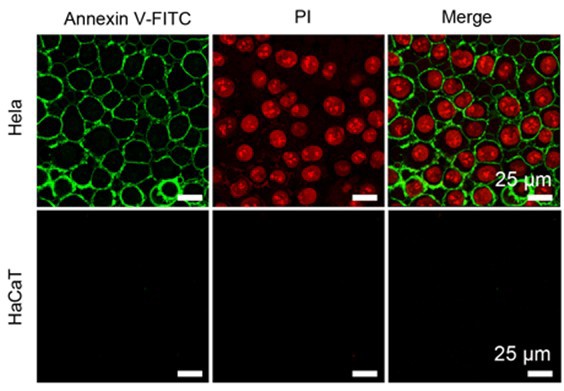
图3. FA-NMe2Se4N2 NP介导的光动力治疗对癌细胞和正常细胞的影响
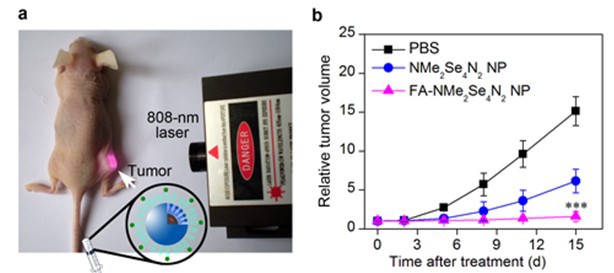
图4. FA-NMe2Se4N2 NP在活体水平对肿瘤的光动力治疗效果