在过去几年中,由SARS-CoV-2病毒引起的新冠病毒肺炎席卷全球。该病毒表面的刺突蛋白(配体)与宿主细胞表面血管紧张素转换酶2(ACE2,受体)之间的相互作用,是病毒入侵细胞的关键步骤。刺突蛋白以三聚体形式存在,可与多个ACE2受体进行多价相互作用,赋予新冠病毒强大的感染能力和免疫逃逸特性。因此,实时追踪并无标记测量配体与受体的多价相互作用,有助于揭示病毒感染机制,开发靶向治疗策略。然而,病毒表面每个刺突蛋白-受体结合作用具有异质性,且多价相互作用具有瞬时性和路径复杂性,使得在单分子水平实时监测其动态过程极具挑战。
37000cm威尼斯龙亿涛/应佚伦团队基于配体-受体结合诱导的体积增大效应,构建了一种配体-受体锚定的限域纳米孔道单分子电化学分析方法,模拟配体在生物界面上的空间取向,从而保持其结构的灵活性和最优的结合取向。团队利用纳米孔道尖端电荷放大效应,将配体-受体的解离和结合动态过程转化为可测量的高时间分辨离子流电信号(图1),实时追踪了SARS-CoV-2奥密克戎变体(Omicron S)、原始毒株(WT S)和德尔塔毒株(Delta S)刺突蛋白与可溶性血管紧张素转换酶2(sACE2)受体间多价相互作用,解析了刺突蛋白的每一个亚基与sACE2的结合和解离速率,从而在单亚基水平揭示了SARS-CoV-2变体刺突蛋白与受体结合路径和动力学差异(图2)。研究发现,Omicron S的三个亚基均具有对sACE2受体同等且极大的亲和能力,倾向于同时与三个受体结合,而WT S和Delta S则分别倾向于仅与一个或两个受体结合,且在与第一个sACE2结合后,其第二个亚基的结合能力显著下降(图3)。
研究提供了一种在单分子水平追踪复杂蛋白-蛋白复杂动态相互作用网络的新方法,为理解病新冠毒感染的分子机制,以及靶向药物设计和治疗策略提供了重要参考。
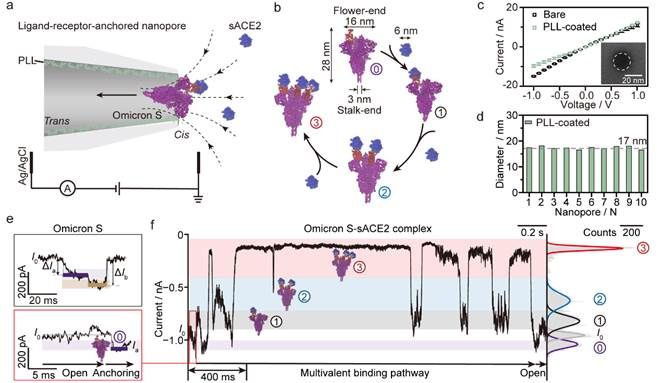
图1. 配体-受体锚定纳米孔道单分子电化学分析实时追踪多价相互作用.
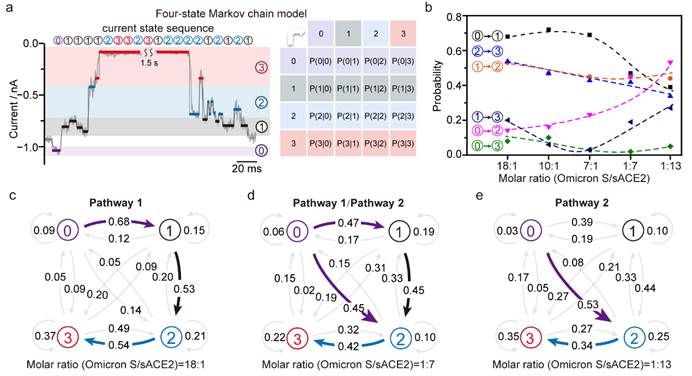
图2. 单分子水平解析Omicron S随sACE2受体浓度依赖的结合路径.
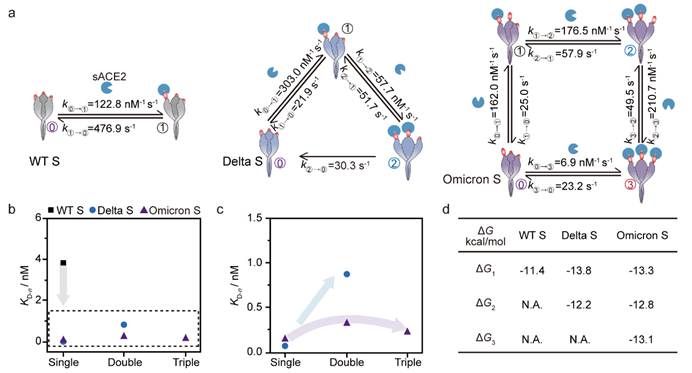
图3. 纳米孔道单分子电化学技术测量同源刺突蛋白和sACE2的结合及解离动力学行为.
该工作以“Label-Free Mapping of Multivalent Binding Pathways with Ligand-Receptor-Anchored Nanopores”为题,于2024年8月24日在《Journal of the American Chemical Society》发表(DOI: https://doi.org/10.1021/jacs.4c04934)。37000cm威尼斯化学化工学院马慧副研究员与应佚伦教授为论文共同通讯作者,马慧副研究员与王勇勇(2021级硕士)为论文的共同第一作者,此研究工作获得了国家自然科学基金原创探索计划等项目资助。