根据世界卫生组织统计,癌症已成为全球主要死因之一,严重威胁着人类的生命和健康。因此,迫切需要有效的抗癌手段来控制这一重大疾病。免疫检查点阻断(ICB)疗法是通过阻断共抑制信号通路以激活机体自身免疫系统来杀伤肿瘤细胞,为人类攻克癌症带来了曙光。结合课题组的优势技术和ICB这一前沿研究,我校刘震教授团队开发了两款新型免疫检查点阻断制剂,用于抗肿瘤免疫治疗。
PD-1与PD-L1相结合可传递免疫抑制信号,阻止T细胞活化,从而促进肿瘤细胞的免疫逃逸。因此,阻断PD-1/PD-L1轴已成为激活T细胞介导抗肿瘤免疫应答的有效策略之一。鉴于此,课题组利用硼亲和锚定分子印迹技术,设计与制备一种肿瘤细胞靶向的分子印迹溶酶体纳米降解剂(MILND)。不同于传统治疗性抗体通过结合靶蛋白多肽结构域来阻断其信号通路,本研究中制备的MILND通过识别N-端表位特异性绑定肿瘤细胞表面PD-L1蛋白,促进肿瘤细胞摄取。该过程进一步诱导PD-L1转运至溶酶体降解,下调肿瘤细胞表面PD-L1的表达水平。作为结果,MILND逆转PD-L1介导的肿瘤免疫抑制效应,并引发持久的抗肿瘤免疫应答(图1)。这一研究成果近期发表在ACS Nano杂志上。我校化学化工学院已毕业博士生卢海峰和20级博士生官佩鑫为文章的共同第一作者,刘震教授为文章的通讯作者。
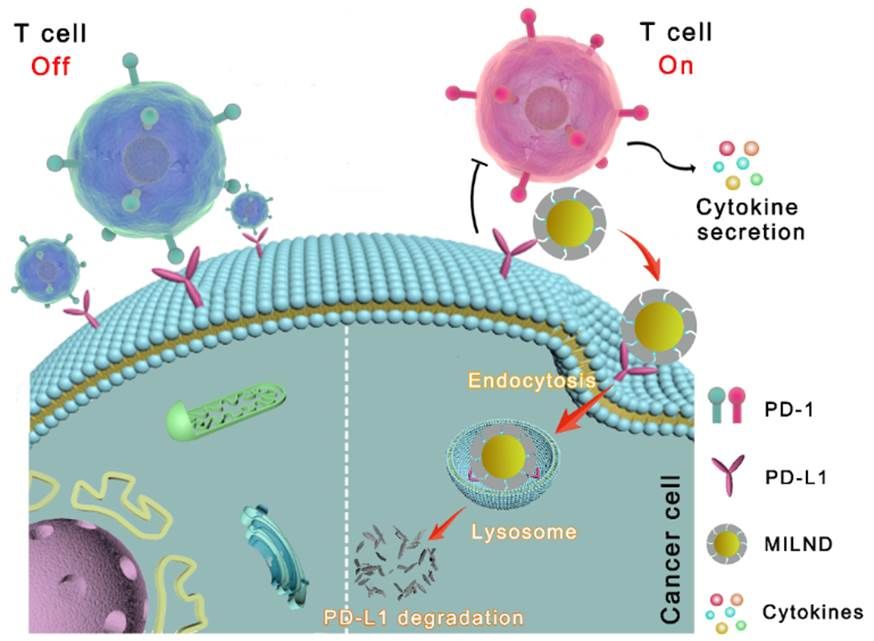
图1 MILND逆转PD-L1介导肿瘤免疫抑制效应的示意图
另一方面,鉴于CD47/SIRPα免疫检查点在巨噬细胞介导的“别吃我”信号通路中发挥的重要作用,课题组利用可控印迹包覆策略,以SIRPα N-端表位为靶标,制备一种巨噬细胞靶向分子印迹溶酶体降解剂用于抗肿瘤免疫治疗(图2)。制备的MILND原位特异性识别肿瘤相关巨噬细胞表面的SIRPα。随后,MILND-SIRPα复合物以胞吞方式转移至溶酶体降解,激活PI3K/Akt信号通路,最终触发巨噬细胞介导的抗肿瘤免疫应答。此外,吞噬细胞呈递的肿瘤抗原也有效促进T细胞活化及其介导的肿瘤杀伤。这一研究成果近期发表在Nano Today杂志上。我校化学化工学院21级博士生韩延杰为文章的第一作者,刘震教授为文章的通讯作者。
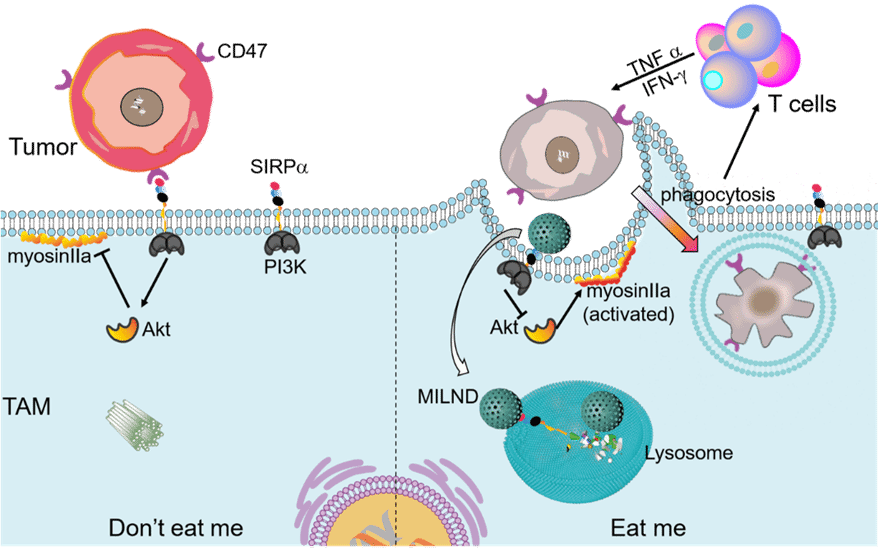
图2原位重编辑肿瘤相关巨噬细胞增强癌症免疫治疗的示意图
综上所述,相关研究立足于溶酶体纳米降解剂的特异性识别和“内体-溶酶体”转运特性,实现了细胞膜蛋白的靶向降解,为ICB制剂的开发提供新的设计思路。相关研究得到国家自然科学重点项目(21834003)、青年项目(22007046)和37000cm威尼斯卓越计划(ZYJH004)等的支持。
论文相关信息:
[1] Haifeng Lu,# Peixin Guan,# Shuxin Xu, Yanjie Han, Zhen Liu*, Boosting cancer immunotherapy via reversing PD-L1-mediated immunosuppression with a molecularly imprinted lysosomal nanodegrader, ACS Nano, 2024,
https://pubs.acs.org/doi/10.1021/acsnano.4c07416
[2] Yanjie Han, Haifeng Lu, Zikuan Gu, Peixin Guan, Zhen Liu*, In situ reprogramming of tumor-associated macrophages enhances cancer immunotherapy, Nano Today, 2024, https://doi.org/10.1016/j.nantod.2024.102420