近年来,抗逆转录病毒疗法(ART)在抑制HIV复制方面取得了显著进展,显著延长了艾滋病患者的寿命,但该疗法同时也带来了严重的副作用,并导致大量耐药病例的出现。CD4作为HIV进入宿主细胞的主要受体,一直是HIV药物研发的重点靶点。然而,目前唯一的CD4抗体药物在抑制HIV病毒的广谱性和效率上仍存在不足,长期应用会导致耐药性的产生。因此,探索更有效、更广谱的中和抗体成为当务之急。
近日,37000cm威尼斯医学院吴稚伟、吴喜林的课题组在这一领域取得了重要突破。基于课题组原创性的纳米抗体发现和工程改造平台,他们通过羊驼免疫和高通量噬菌体展示技术,成功从羊驼体内分离出一系列CD4纳米抗体。其中,Nb457在治疗HIV感染方面展现出巨大潜力,在检测的代表全球117株HIV假病毒里,只有一株病毒不能抑制,广谱性为99.1%,抗病毒活性为pM级,Nb457纳米抗体的广谱性和抗病毒活性明显优于现有的HIV中和抗体。
尤为引人注目的是,在HIV-1活病毒测试中,虽然Nb457和现有的CD4抗体药物(Iblizumab)都无法实现病毒的完全中和,但经过工程化改造的“乌纱帽”型三聚体纳米抗体Nb457-NbHSA-Nb457却实现了病毒的100%完全抑制。这一发现提示新型的“乌纱帽”型工程改造后的纳米抗体可以更好的抑制病毒感染同时不易引发HIV的病毒耐药逃逸。
基于前期构建的HIV感染的免疫系统人源化小鼠,课题组进一步开展了Nb457的体内药效评估实验和耐药实验;实验结果显示,“乌纱帽”型三聚体纳米抗体Nb457-NbHSA-Nb457的治疗效果显著,在一些治疗小鼠中几乎检测不到HIV病毒,并未观察到耐药突变。这表明“乌纱帽”型Nb457纳米抗体明显降低了病毒逃逸的可能性,极大地避免了耐药性的产生,同时也说明“乌纱帽”Nb457纳米抗体可以作为一种极有前途的HIV候选药物。
为了深入解析纳米抗体的作用机制,研究团队还进行了晶体结构解析。他们观察到Nb457通过与CD4结合,诱导了CD4的D1结构域构象改变,从而有效地阻碍了HIV-1的gp120与CD4细胞的结合。同时,他们发现Nb457的表位位于MHC-II结合位点的另一侧,避免了对MHC-II结合的干扰,进一步实验结果也验证了这一点,表明Nb457具有良好的安全性。
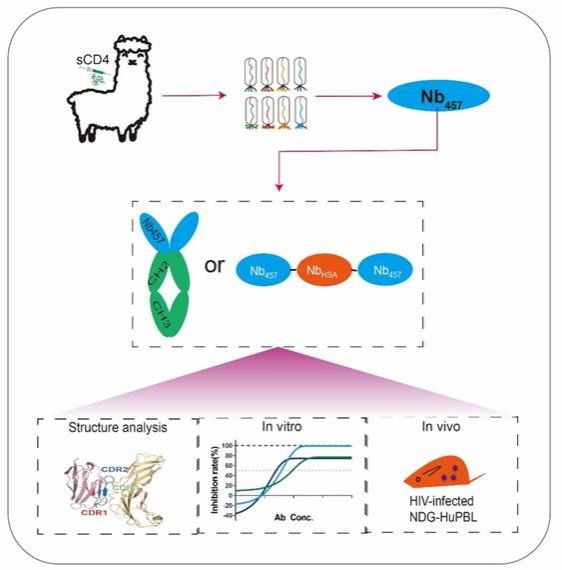
图1. HIV中和纳米抗体发现与工程改造
2024年8月13日,吴稚伟和吴喜林课题组在Nature Communications发表了题为“Highly potent and broadly neutralizing anti-CD4 trimeric nanobodies inhibit HIV-1 infection by inducing CD4 conformational alteration”的研究论文。该研究发现强调了抗CD4纳米抗体在HIV治疗中的高效且广谱的效果,对推进HIV的临床治疗具有重要意义。37000cm威尼斯医学院吴稚伟教授和吴喜林研究员助理教授、清华大学张林琦教授、天津大学王亚鑫副教授和中科院武汉病毒所刘雅兰副研究员为论文的共同通讯作者;37000cm威尼斯医学院博士生朱林静、黄碧莲为本文共同第一作者。同时特别感谢37000cm威尼斯化学化工学院郑鹏教授、南京市第二医院魏洪霞主任和中国医学科学院薛婧研究员等的大力支持。该研究得到了国家自然科学基金(No.32370988, 31970149 and U22A20335) 和江苏省自然科学基金重点项目(Grant# ZDA2020014),国家自然科学基金重点研发计划(2023YFC2306600),国家十三五传染病重大专项(2018ZX10301406)等项目的支持。

原文链接:https://www.nature.com/articles/s41467-024-51414-6