磷酸化调控的离子通道在神经元和心肌细胞活性的调控中扮演关键角色,深入了解这一复杂过程对于评估与蛋白质磷酸化相关的细胞发育以及相关疾病(包括代谢紊乱、精神疾病、免疫功能障碍和恶性肿瘤)的诊断至关重要。通过人工流体系统构建的磷酸化响应离子通道能够有效传递翻译后修饰的信号,模仿和增强关键细胞功能,对于精准的生物分子检测和细胞通讯研究具有重要意义。然而,目前调节磷酸化响应离子通道的方法主要依赖于空间位阻或表面电荷调制,而且,在磷酸化激活的人工纳米通道中实现离子运输的精确操纵仍然是一个重大挑战。
37000cm威尼斯生命科学学院李根喜教授团队最近提出了一项生物启发磷酸化响应离子通道控制新技术。该团队创新性地将多肽作为蛋白激酶的识别底物兼纳米粘合剂,成功将氧化石墨烯引入纳米通道系统,这一独特的调控手段不仅调整了纳米通道表面的空间位阻和润湿性,创造了一个实质性的离子传导屏障,提高了离子运输的可控性,而且在这一创新设计基础上,团队还成功研发了一种灵敏的生物传感器,可用于检测蛋白激酶A(PKA)的活性,具有操作简便、无需标签和低成本的显著优势。
李根喜教授团队之前在功能化纳米通道中离子传输调控方面开展了许多工作(J. Am. Chem. Soc. 2019, 141, 8239–8243; Anal. Chem., 2021, 93: 16646-16654; Nano Lett. 2022, 22, 1083–1090),为本项技术研究提供了基础,因而成功实现了对纳米通道空间位阻和润湿性的同时调控,并构建了一个可以被PKA催化磷酸化调节的仿生离子门控(见图1)。研究团队模拟了PKA调控的L型钙离子通道的过程,并巧妙地运用响应肽作为PKA特异性磷酸化靶点,因此多肽在磷酸化状态下避免了被蛋白酶消化,从而成为氧化石墨烯与纳米通道的理想纳米粘合剂。这一巧妙设计产生的空间位阻和润湿性的巨大变化显著地阻碍了离子传输,而未经磷酸化的纳米通道则容许离子的自由运输。
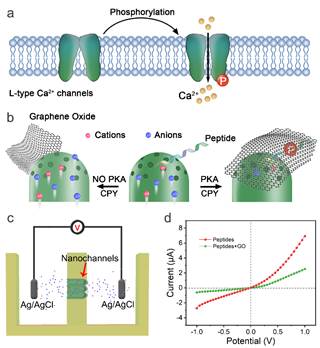
图1 高度可控的仿生磷酸化离子通道构建原理。图片来源:Nano Letters
研究团队通过对氧化石墨烯纳米片调制离子传输的详细分析,验证了多肽促进氧化石墨烯形成涂覆层的能力,并确定了具有最佳门控性能和稳定性的氧化石墨烯的尺寸与浓度。此外,他们还通过测量纳米通道表面接触角的变化,确认了氧化石墨烯对纳米通道表面润湿性的改变。这一研究不仅拓宽了离子通道调控的新途径,同时为生物传感分析领域引入了创新的技术手段。
为实现PKA的灵敏检测,并鉴定其抑制剂或激活剂,以推动疾病早期诊断及发现潜在的激酶靶向药物,研究人员进一步通过将多肽序列RRASLG嵌入响应肽作为PKA的识别底物,成功研发了一种操作简便、无需标记和低成本的高灵敏生物传感器。研究结果表明,通过氧化石墨烯和多肽之间的相互作用,离子门能够特异而高效地响应磷酸化,并将位阻差异转化为PKA分析的离子电流。此外,在+1 V时纳米通道中的电流值与PKA浓度之间呈线性相关,实现了对PKA的精准定量检测(图2)。
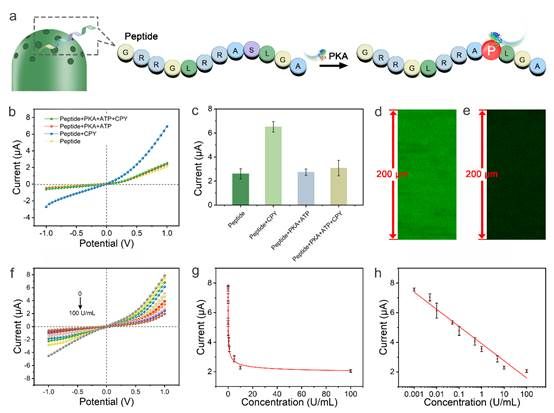
图2 基于氧化石墨烯增强离子流动调控的PKA电化学检测。图片来源:Nano Letters
为了进一步验证他们所研制的生物传感器的性能,研究团队进行了一系列实验证明其具有良好的特异性与抗干扰性。他们还通过对PKA抑制剂的预处理实验证明了生物传感器在筛选PKA抑制剂方面的潜力。最后,研究人员发现该生物传感器在体外测定细胞裂解液中PKA活性方面表现出色(图3)。
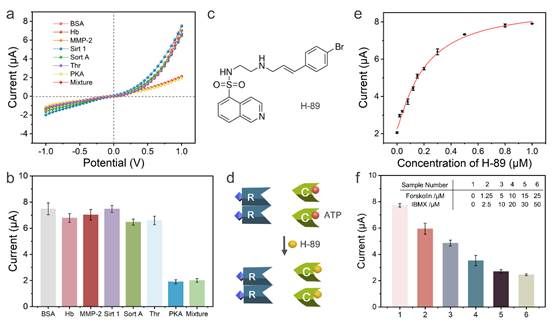
图3 生物传感器的性能验证。图片来源:Nano Letters
综上所述,李根喜教授团队提出了一种仿生磷酸化响应离子通道,通过双功能多肽的精确识别和氧化石墨烯涂层的体积排斥和润湿性调节,实现了对离子运输的高效调控。此外,他们利用多肽的磷酸化与蛋白酶水解反应,还研发了一种高特异性、高稳定性、超灵敏检测PKA活性的生物传感器。这一研究成果有望为生物启发离子通道研究提供新的思路,并在生物医学诊断和药物发现领域展现出广阔的应用前景。
上述研究成果以“Graphene Oxide-Mediated Regulation of Volume Exclusion and Wettability in Biomimetic Phosphorylation-Responsive Ionic Gates”为题发表在Nano Letters(DOI: 10.1021/acs.nanolett.3c02924),李根喜教授与现在南京市第二医院检验科工作的李金龙副主任为论文的共同通讯作者,现在上海大学生命科学学院从事博士后研究并入选2022年“全国博士后创新人才计划”的石榴博士以及37000cm威尼斯生命科学学院硕士研究生聂贝贝为论文共同第一作者。该研究得到了全国博士后创新人才计划、上海市超级博士后计划,以及中央高校基本科研基金的支持。