我院陶云龙课题组与合作者揭示了人类蓝斑(Locus coeruleus, LC)去甲肾上腺素能神经元(Norepinephrine neuron, NE)发育过程中的关键信号通路,并其基于此发现实现了其体外的高效分化。该研究成果为去甲肾上腺素能神经元的相关研究提供的良好的模型,使我们有机会进一步理解它在相关神经系统疾病中的作用,也让开发药物,治疗相关疾病成为可能。
蓝斑核,简称蓝斑,是主要由去甲肾上腺素能神经元组成的神经核团。它是中枢神经系统中合成去甲肾上腺素的主要部位,参与许多重要的生理功能如觉醒,清醒,应激反应,注意力集中,记忆及应激反应等。蓝斑去甲肾上腺素能神经元的功能异常还与众多神经系统疾病有着密切的关联。然而,目前我们对于蓝斑去甲肾上腺素能神经元在这些神经系统疾病中的具体功能依然知之甚少,其中一个最重要的原因是因为缺乏很好的细胞模型可以在体外模拟人类的去甲肾上腺素能神经元。通过从多能干细胞(Pluripotent stem cell, PSC)分化得到真正、可靠的去甲肾上腺素能神经元理论上可以有效地解决这一困境。然而,由于前期对人类蓝斑去甲肾上腺素能神经元发育过程的研究较少,我们对其发育过程中的命运调控机制还不甚了解,其体外分化的系统至今尚未实现,严重制约了相关领域的研究进展。
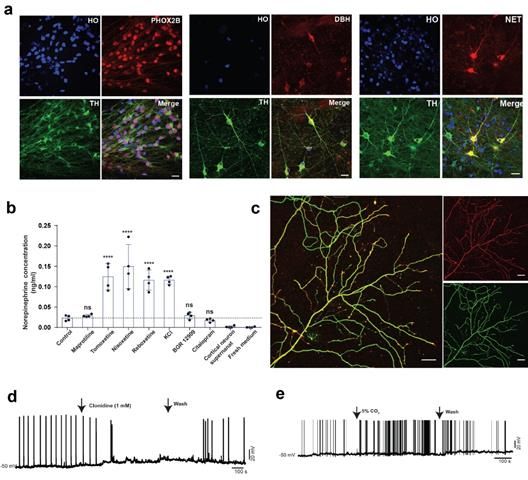
研究人员经过大量筛选发现ACTIVIN A可以有效地诱导去甲肾上腺素能神经组细胞的产生。分化得到的去甲肾上腺素能神经元具有与体内去甲肾上腺素能神经元相似的特征如生产、释放和回收去甲肾上腺素神经递质,大量的轴突分支,CO2感应等。这一系列去甲肾上腺素能神经元特有的特征进一步表明多能干细胞分化的细胞是有功能的去甲肾上腺素能神经元。为了进一步验证多能干细胞分化的去甲肾上腺素神经细胞,研究人员开展了多时间点的单细胞测序实验,动态地分析了处于分化中的细胞组成及其分化途径,证实了去甲肾上腺素神经细胞表达分子标记物及其比例。另外与体内组织的单细胞数据比较,研究人员发现,去甲肾上腺素神经细胞的基因表达与胚胎期小鼠蓝斑区域的细胞高度相似,进一步验证了该细胞类型。为了展示多能干细胞分化得到的去甲肾上腺素能神经元的应用,研究人员通过基因编辑技术将可以感应去甲肾上腺素神经递质的基因(NE sensor)插入到人多能干细胞的基因组中,再通过去甲肾上腺素能神经元体外的分化方法得到可以同时生产、释放、回收以及检测的去甲肾上腺素能神经元。这一细胞平台可以用于筛选药物来治疗那些由于去甲肾上腺素神经递质发生紊乱而导致的神经系统疾病(抑郁等)。作为该概念的验证,研究人员发现,目前市场用于治疗抑郁的药物中,靶向去甲肾上腺素神经递质的重回收过程的药物可以显著提高NE sensor的信号强度,而那些靶向多巴胺或血清素神经递质的药物却对NE senor没有明显影响。这些结果表明该药物筛选平台可以用于高通量地寻找靶向调控去甲肾上腺素神经递质的新型药物。
研究成果以 “Generation of Locus Coeruleus Norepinephrine Neurons from Human Pluripotent Stem Cells”为题,将于2023年11月17日在《Nature biotechnology》上发表,原文链接: https://doi.org/10.1038/s41587-023-01977-4。37000cm威尼斯生命科学学院及化学和生物医药创新研究院双聘博士生导师陶云龙研究员为该论文的第一作者兼共同通讯作者,威斯康辛大学麦迪迅分校的Su-Chun Zhang教授为论文的共同通讯作者。陶云龙博士是国家级青年人才计划入选者,其课题组(https://life.nju.edu.cn/tyl/list.psp)常期招聘优秀研究生,博士后等,有意者请联系:taoyunlong@nju.edu.cn。